Nomini il potassio, e tac, l’associazione è fatta: nell’immaginario collettivo si materializza una banana. Se ci fosse una tavola periodica dei luoghi comuni la casella numero 19 sarebbe facile da compilare come la 26, Ferro/ spinaci o la 15, fosforo/ pesci, Spargendo poi un po’ di simboli di veleno ed esplosivo a pioggia sulle caselle rimaste ecco disegnata anche la tavola delle conoscenze (!!!) chimiche di gran parte dellea popolazione. Lo scopo di questo articolo, però non è quello di lasciare tracce indelebili nel bagaglio scientifico degli italiani , ma quello, molto più modesto, di liberare il potassio dall’involucro giallo che lo attanaglia: sbucciarlo, insomma, mostrandone alcune proprietà .
La nascita. Il potassio è un “metallo stellare”, cioè uno di quegli elementi che le stelle
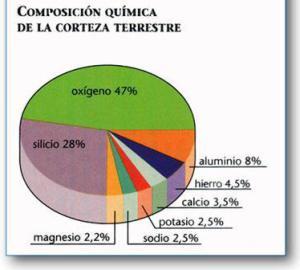
Con altri elementi, il potassio ha poi contribuito alla formazione di questo pianeta concentrandosi soprattutto nella crosta terreste. e collaborando alla produzione degli organismi viventi e dell’uomo.
http://zibalsc.blogspot.it/2012/01/93-clorofilla-ed-emoglobina.html
La scoperta Non essendo un metallo nobile e quindi non trovandosi mai allo stato nativo ossia puro come l’oro, l’argento e il rame, e formando molti composti insolubili, il potassio è stato scoperto solo nel 1807. Questo non gli impedì di arrivare primo; fu infatti il primo elemento scoperto con il processo elettrolitico.
“Dopo aver concluso, una ricerca sull’ elettrolisi dell’acqua pura e di varie soluzioni, Davy rivolse la propria attenzione ai sali fusi: l’anno successivo nel mese di ottobre, immerse il filo di platino dell’elettrodo della sua batteria, nella potassa fusa e riuscì quasi subito a decomporla, producendo un nuovo metallo estremamente reattivo. Alla fine dell’esperimento, Davy si mise a ballare estasiato in mezzo alla stanza. Raccontò suo cugino Edmund che gli faceva da assistente.”
Hugh Aldersey Williams “Le favole periodiche “
Il nome. Humphrey Davy doveva essere un tipo modesto dal momento che non chiamò il nuovo elemento Davio o Davienio, ma potassio, avendolo ottenuto dalla potassa, (idrossido di potassio). Una piccola perfidia ci fu nella scelta di quel simbolo, K ,da Kalium, (forse da alkali) che da sempre confonde lo studente!
L’aspetto Come già detto, il potassio non si trova in natura allo stato nativo, vale a dire puro. La sua reattività lo impedisce. Ecco uno dei minerali che lo contiene, la silvite 
E’ inoltre difficilissimo da conservare senza che si ricopra di una specie di corteccia che ne cela ogni lucentezza metallica. Questo è il potassio, conservato sotto etere di petrolio, nell’ laboratorio dell’Oriani di Faenza.
Risultati migliori si ottengono conservandolo in atmosfera di argon

Le proprietà Il potassio fa parte del primo gruppo della tavola periodica; é quindi un metallo alcalino. Se pensate ai metalli come sostanze dure, con alto punto di fusione e dense ecco, il potassio non è così: é tenero, bassofondente, galleggia in acqua e per di più è talmente reattivo da sembrare addirittura diabolico. Ve lo presento con alcuni filmati. Il primo è tratto da un video realizzato da un gruppo di miei studenti, per un progetto di qualche anno fa
Il secondo è uno dei fantastici video della serie “periodic table of videos” in cui oltre alle spettacolari esplosioni, viene illustrato un metodo per ottenere uno specchio di potassio.
E per parlare delle proprietà del potassio in modo letterario, voglio riportare due brani tratti da due splendidi libri costruiti intorno alla chimica. Il primo è tratto da “zio Tungsteno” di Oliver Sacks:
Avevevo letto di come Davy avesse scoperto prima di tutto il potassio e di come quest’ ultimo reagisse con l’acqua; così ne tagliai un cubetto ( si tagliava come il burro e la superficie esposta riluceva di un bianco argenteo brillante- ma solo per un attimo perchè anneriva immediatamente). Presi il cubetto con attenzione e lo calai in un recipiente d’acqua facendo un passo indietro – appena in tempo gicché il potassio prese fuoco all’istante, agitandosi freneticamente nel recipiente come una massa fusa sormontata da una fiamma violetta, schizzando e crepitando mentre lanciava lapilli incandescenti in tutte le direzioni. Pochi secondi e il picolo globulo era completamente cosumato, e nell’acqua del recipiente era tornata la tranquillità. Ora però l’acqua era calda e saponosa; era diventata una soluzione di potassa caustica, che, essendo alcalina, faceva virare al blu una cartina al tornasole.”
Il secondo brano è tratto dal racconto “Potassio ” uno degli elementi del “Sistema Periodico” di Primo Levi. E’ un racconto denso di significati in cui ogni riga può diventare spunto di riflessione. Fra le tante cose, l’autore descrive l’incendio da lui innescato per aver trattato il potassio, utilizzato nella distillazione del benzene per i suoi effetti disidratanti al posto del sodio non disponibile nel vecchio laboratorio, senza le dovute precauzioni. Il suo racconto si conclude così:
“Io pensavo ad un’ altra morale più terrena e completa, e credo che ogni chimico militante la potrà confermare: che occorre diffidare del quasi- uguale ( il sodio è quasi uguale al potassio ma col sodio non sarebbe successo nulla) del praticamente identico, del pressapoco, dell’oppure, di tutti i surrogati e di tutti i rappezzati. Le differenze possono essere piccole ma portare a conseguenze radicalmente diverse, come gli aghi degli scambi; Il mestiere del chimico consiste in buona parte dal guardarsi da queste differenze, nel conoscerle da vicino, nel prevederne gli effetti . Non solo il mestiere del chimico.”
Atomo e ione Il potassio occupa la casella n° 19 della tavola periodica il che significa che ha 19 protoni nel suo nucleo e 19 elettroni nei suoi orbitali. La configurazione elettronica, ovvero il modo in cui i suoi elettroni si dispongono sugli orbitali, si può scrivere cosi
[Ar]s1
dove: Ar è il simbolo del gas nobile Argon, s è l’obitale 1 è il numero di elettroni presenti su quell’orbitale. E così, a colpo d’occhio, si vede quanto poco gli ci voglia per essere almeno un po’ simile all’argon e avere solo orbitali completi. Gli basterebbe eliminare quell’ unico elettrone e… Ecco quindi che l’irrequietezza del potassio, la sua formidabile reattività ( e quella degli altri elementi del suo gruppo) può essere spiegata con la tendenza a disfarsi dell’ ingombrante elettrone.
Ai tempi di Davy, ancora non si sapeva nulla di atomi, elettroni e strutture atomiche; la scoperta dei metalli alcalini, però, attraverso elettrolisi di sali fusi fece entrare direttamente nel mondo deglio ioni. Perchè nei sali fusi il potassio migra sempre verso un elettrodo e il cloro verso quello opposto? Davy ne dedusse che nei sali gli elementi erano presenti come particelle cariche . Faraday, suo allievo chiamò ioni le particelle cariche di un elemento distinguendo in ioni positivi, cationi e ioni negativi anioni. Il potassio era uno ione positivo K+ uno dei più reattivi.
I composti del potassio Ma alla fine a che cosa serve il potassio? Se il potassio puro non ha molte applicazioni, ben diverso è il discorso quando consideriamo i sali di potassio. In un libro che potrebbe essere degli anni ’50 ( non sono riuscita a ricavare la data!) ho trovato una manciata di illustrazioni che pubblicizzavano i diversi impieghi dei sali di potassio.
Questa presentazione richiede JavaScript.
Fra gli svariati usi vorrei sottolinearne uno in particolare: come fertilizzante. Il potassio viene assorbito dalle piante, passa dai vegetali agli animali e ritorna in parte nel terreno attraverso gli escrementi e i resti di vegetali e animali; un ciclo che non è chiuso e il terreno ne esce impoverito. Per la solubilità in acqua dei suoi sali, infatti, una parte del potassio viene lisciviato dalle piogge e finisce nelle falde sotterranee, nei fiumi, nei laghi e, infine, nel mare. E’ necessario quindi ripristinare il potassio disperso con concimazioni ricche in questo elemento. I contadini usavano la cenere, una pratica decisamente distruttiva. Fu un chimico tedesco Adolf Frank (1834-1916), che a metà dell’ ottocento condusse accurati studi geologici in una regione della Germania, che si rivelò ricchissima di minerali di potassio utilizzabili come concimi. Questo fu l’atto di nascita dell’importanza commerciale dei sali di potassio come racconta Giorgio Nebbia nel bellissimo articolo NPK: K per potassio. Importanza che è ancora di grande attualità se un articolo di qualche mese fa titolava: “Moska- Minsk la guerra del potassio” riferendosi alla battaglia commerciale fra i più grandi produttori di fertilizzanti che da soli si assicurano oltre il 40% del mercato mondiale.

miniera di potassio della Uralkali
Per quanto riguarda le funzioni dello ione potassio nel nostro organismo voglio solo ricordare la funzione della pompa sodio potassio che utilizza l’energia di decomposizione dell’ATP per traslocare ioni sodio verso l’esterno e ioni potassio verso l’interno della membrana cellulare per mantenere un gradiente di concentrazione indispensabile per molte funzioni come, ad esempio, la trasmissione di rapidi segnali fra cellule e lungo le cellule del tessuto nervoso.
Sempre per quanto riguarda il corpo umano, sapevate di essere radioattivi?
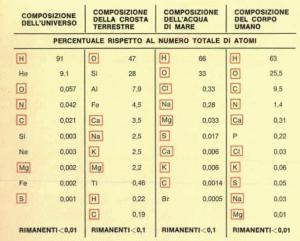
Il protagonista della radioattività naturale è il Potassio-40, che è presente nel nostro corpo e in generale nella materia biologica, nei cibi, nella crosta terrestre e nell’acqua di mare. L’uomo medio contiene circa 140 grammi di Potassio, ingerito attraverso i cibi al ritmo di circa 2.5 grammi al giorno. Il potassio-40 costituisce lo 0,012% del potassio naturale, e la quantità presente all’interno del corpo umano vale quindi 1,7 mg, per un’attività totale di 5⋅103Bq vale a dire, circa 5000 decadimenti di 40K al secondo!
Poesia Un elemento così particolare come il potassio non può non aver ispirato un qualche verso poetico. Propongo due poesie , una di Davy dedicata al fuoco dei metalli, l’altra tratta, da ” sodio e potassio” é una poesia della raccolta ” La chimica in versi” di Alberto Cavaliere
Guarda, sopra la terra si riversano gli spiriti infuocati
le fiamme della vita dicui la Natura è prodiga;
La limpida rugiada diventa un fiore roseo,
La polvere inanimata si risveglia, e si muove, e vive
H. Davy
….
Sostanza solida,
molto leggera
e quasi tenera
come la cera,
teme l’ossigeno
quest’elemento:
tagliato luccica
come l’argento,
ma poi dall’aria
scomposto viene,
mentre il petrolio
lo cura bene;
così che, massime
per questo fatto,
non s’usa libero
che poco o affatto.
Ma indispensabili,
a tutti i costi,
sono moltissimi
dei suoi composti,
… A. Cavaliere
Ah dimenticavo, percepiamo il potassio salato, come il sodio e lo troviamo … nelle banane





