Illustrazione: Goni Montes
Articolo di Charles Seife su “Le Scienze” trad. Stefano Fabbri, fonte Sigrid Estrada
La ricerca farmaceutica è affidabile ?
Le aziende farmaceutiche pagano scienziati per importanti ricerche che riguardano i loro prodotti. E nessuno sembra in grado di fermarle.

Quando Robert Lindsay decise di dedicarsi alla ricerca medica, all’inizio degli anni settanta, non lo fece per denaro. Il suo campo di interesse, l’effetto degli ormoni sul tessuto osseo, era in fase di stasi. Per un giovane ricercatore quel campo era un’opportunità per lasciare il segno e, almeno così sperava, per aiutare migliaia di persone che soffrivano di osteoporosi. A volte, quando il corpo invecchia, le ossa perdono la capacità di ricostruire il proprio tessuto con la rapidità necessaria a tenere il passo del normale processo di usura, e lo scheletro si indebolisce.
Nessuno capiva granché delle dinamiche di questo fenomeno, compreso Lindsay. Ma c’erano buone ragioni per credere che fossero coinvolti gli ormoni. Alcune donne sviluppano osteoporosi subito dopo la menopausa, quando i loro livelli ormonali crollano bruscamente, forse alterando il bilancio fra formazione e distruzione del tessuto osseo. Se era così, pensava Lindsay, la sostituzione degli ormoni con una pillola avrebbe bloccato o addirittura invertito la progressione della malattia. A Glasgow, in una clinica piccola e con pochi finanziamenti, il giovane ricercatore aveva programmato uno dei primi trial della terapia ormonale sostitutiva a base di estrogeni per la perdita di tessuto osseo in donne in post-menopausa. La stella di Lindsay stava sorgendo.
Il suo progetto successivo ebbe enormi implicazioni commerciali e catturò l’attenzione dell’industria farmaceutica. Dopo essersi trasferito all’Helen Hayes Hospital, un centro di riabilitazione a nord di New York, nel 1984 Lindsay aveva pubblicato uno studio in cui determinava la dose minima efficace di un farmaco antiosteoporotico con estrogeni chiamato Premarin. I risultati suggerivano che combattere l’osteoporosi equivaleva a incoraggiare milioni di donne a usare il farmaco, e questo aveva reso Lindsay un personaggio di spicco agli occhi di Wyeth-Ayerst Laboratories, azienda produttrice di farmaci, che in effetti arruolò Lindsay tra gli autori del proprio video informativo Osteoporosi: una tragedia che si può prevenire. A metà degli anni novanta, quando Wyeth fu coinvolta in una lite brevettuale relativa al Premarin, Lindsay era un alleato fedele dell’azienda. Il ricercatore si era espresso contro l’approvazione di una versione generica del farmaco che avrebbe fatto perdere quote di mercato, anche se il generico avrebbe facilitato l’accesso alla terapia. Secondo Lindsay, un farmaco generico avrebbe potuto non essere del tutto equivalente al farmaco registrato (o «griffato»), un fatto che in alcuni casi può essere vero. Questa posizione però era anche in linea con la posizione dell’azienda. «Tutto ciò che chiediamo è di non approvare qualcosa di cui in futuro ci pentiremo», dichiarò all’Associated Press nel 1995. Lo stretto rapporto di Lindsay con Wyeth e altre case farmaceutiche proseguì per decenni, con modalità spesso nascoste. Il ricercatore consentì a Wyeth di scrivere le bozze dei suoi articoli e incassò decine di migliaia di dollari da interessi farmaceutici che avevano tutto da guadagnare dalle sue ricerche.
Lo scandalo non è quello che ha fatto Lindsay, dal momento che il suo è un caso tipico. Negli ultimi anni le case farmaceutiche hanno trovato molti modi per mettere ingenti somme di denaro – in alcuni casi sufficienti per garantire a un figlio la frequenza all’università – nelle tasche di medici indipendenti che effettuano ricerche riguardanti, in modo diretto o indiretto, farmaci in fase di produzione o commercio da parte di queste aziende. Il problema non riguarda solo imprese e ricercatori, ma il sistema nel suo insieme: istituzioni finanziatrici, laboratori, riviste specialistiche, ordini professionali e così via. Nessuno offre un sistema di controllo in grado di evitare conflitti di interesse. Le organizzazioni, invece, sembrano scaricarsi tra loro le responsabilità, lasciando spazi nell’applicazione di regole in cui ricercatori e aziende si destreggiano con facilità, per poi prendere decisioni coperte da segreto.
«Non c’è un solo settore della medicina o della ricerca accademica, né della formazione medica, in cui i rapporti con le aziende non siano un elemento assai diffuso», afferma il sociologo Eric Campbell, professore di medicina alla Harvard Medical School. Questi rapporti non sono sempre negativi. Dopo tutto, senza l’aiuto delle aziende i medici che fanno ricerca non sarebbero in grado di tradurre le proprie idee in nuovi farmaci. Allo stesso tempo, sostiene Campbell, alcuni di questi rapporti coinvolgono gli scienziati nella vendita di prodotti farmaceutici, invece che nella produzione di nuova conoscenza.
Il rapporto fra ricercatori e case farmaceutiche può assumere forme diverse. Ci sono gli speaker bureau: un’azienda finanzia i viaggi di un ricercatore – spesso in prima classe – in tutto il paese, dove a volte il ricercatore tiene un discorso e mostra diapositive preparati entrambi dall’azienda. Poi c’è il lavoro di ghostwriting: un produttore scrive la bozza di un articolo e paga uno scienziato per firmarlo e sottoporlo al giudizio di una rivista peer review. Infine c’è l’attività di consulenza: un’azienda arruola un ricercatore per avere consigli. «I ricercatori credono che queste aziende li cerchino per la loro intelligenza, ma di fatto vengono dopo il marchio», dice Marcia Angell, già direttore del «New England Journal of Medicine». «Per ingaggiare un ricercatore universitario senior illustre, il tipo di persona che parla ai convegni, scrive libri e articoli specialistici, vale la pena spendere come per 100.000 venditori».
Le riviste peer reviewed sono piene di studi che dimostrano come il denaro proveniente dall’industria farmaceutica stia indebolendo l’obiettività scientifica. Una ricerca del 2009 pubblicata su «Cancer» ha dimostrato che i partecipanti a uno studio vivevano più a lungo quando gli autori avevano conflitti di interesse rispetto a quando gli stessi autori erano non avevano interessi in gioco. Uno studio del 1998 pubblicato dal «New England Journal of Medicine» ha trovato una «forte correlazione» fra le conclusioni dei ricercatori sulla sicurezza dei bloccanti dei canali del calcio, una classe di farmaci usati per ridurre la pressione del sangue, e il loro rapporto finanziario con le aziende che producono i farmaci.
Non si tratta solo di un problema accademico. I farmaci sono approvati o respinti in base a ricerche apparentemente indipendenti. Quando una pillola non funziona come pubblicizzato e viene ritirata dal mercato o rietichettata come pericolosa c’è spesso un percorso di ricerche deviate e di compensi per gli scienziati. Per esempio diversi anni fa, quando i pazienti hanno cominciato a citare in giudizio Wyeth per un altro farmaco basato su estrogeni, Prempro (che è stato correlato al rischio di tumore al seno, ictus e altre malattie), gli accordi di Wyeth per l’attività di ghostwriting e firma di articoli previo pagamento sono diventati una parte centrale del caso.
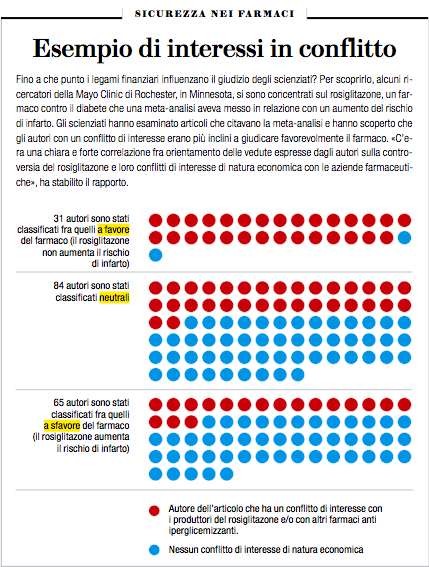
Anche quando è stata la volta dell’analgesico Vioxx, prodotto da Merck e che era stato collegato a infarto e ictus, è emerso il problema del denaro delle case farmaceutiche. In uno studio sul Vioxx, per esempio, sembra che alcuni ricercatori universitari abbiano sottoscritto un progetto sponsorizzato da Merck dopo che l’azienda aveva già effettuato tutte le analisi dei dati. Secondo uno studio del 2010 pubblicato sul «British Medical Journal», l’87 per cento dei ricercatori che hanno dato «parere favorevole» al farmaco per il diabete Avandia, prodotto da GlaxoSmithKline, sebbene ci fossero indicazioni sul fatto che potesse aumentare il rischio di infarto, avevano rapporti finanziari con il produttore del farmaco. E quando una commissione della Food and Drug Administration statunitense ha iniziato a valutare se ritirare o meno Avandia dal mercato a causa del collegamento con gli episodi di infarto è emerso anche che alcuni membri della commissione prendevano denaro dalle case farmaceutiche.
La risposta della comunità scientifica al problema del conflitto di interesse è: trasparenza. Riviste specialistiche, istituzioni che finanziano la ricerca e organizzazioni professionali fanno pressione sui ricercatori affinché dichiarino apertamente – ai soggetti delle loro ricerche, ai colleghi e a chiunque altro sia coinvolto nelle loro attività – quando hanno rapporti che potrebbero compromettere la loro obiettività. In questo modo è la comunità scientifica a decidere se uno studio è etico e, una volta che l’esperimento è stato effettuato, fino a che punto fidarsi dei risultati. È un sistema basato sull’onore. I ricercatori spesso omettono di riferire conflitti di interesse, a volte perché non si rendono nemmeno conto del fatto che questo è un problema. (Anche «Scientific American» chiede che sia rilasciata una dichiarazione volontaria sui conflitti di interesse da parte dei ricercatori che scrivono gli articoli).
In teoria, c’è un sistema di riserva. Diversi livelli di controllo dovrebbero garantire che siano scoperti e resi pubblici i conflitti di interesse anche quando un ricercatore inconsapevole o disonesto non li dichiara. Quando uno scienziato non riferisce dell’esistenza di un simile conflitto è compito dell’università o dell’ospedale in cui lavora scoprirlo e comunicarlo. E quando un’università, o un ospedale, non fa il suo lavoro individuando ricerche con conflitti di interesse, allora dovrebbe scendere in campo l’agenzia governativa che finanzia la maggior parte di questi studi, come gli statunitensi National Institutes of Health (NIH).
Purtroppo il sistema di riserva fa acqua da tutte le parti. «Spesso le istituzioni ragionano in modo opposto, oppure hanno politiche abbastanza deboli», dice Adriane Fugh-Berman, professore al Dipartimento di farmacologia e fisiologia della Georgetown University. Più incredibile ancora è constatare che gli NIH, oltre a non far rispettare norme etiche pensate per fermare la strisciante influenza del denaro delle case farmaceutiche, potrebbero addirittura violare quelle stesse norme.
Il Parlamento degli Stati Uniti cerca di fermare la corruzione nel campo della ricerca medica attraverso l’approvazione di nuove leggi. Nel 2010, nell’ambito di un pacchetto di riforme sulla sanità, il Parlamento ha approvato il Physician Payments Sunshine Act. A partire dal 2013 la legge imporrà alle case farmaceutiche e ai produttori di dispositivi medicali di dichiarare la maggior parte dei soldi che versano nelle tasche dei medici. Dato che la maggior parte dei medici che fanno ricerca si occupano anche di pratica clinica, questi dati dovrebbero aiutare università e ospedali dove si fa ricerca e gli NIH a scoprire i casi in cui il medico che riceve un finanziamento ha un potenziale conflitto di interesse. Tuttavia, se non saranno usate, le informazioni andranno sprecate.Il caso di Robert Lindsay mostra quanto sia grave il problema delle ricerche mediche che hanno conflitti di interesse, e quanto sarà difficile rimediare.
Un intrico di rovi
Spesso gli sforzi che le case farmaceutiche compiono per influenzare le conferenze scientifiche iniziano dal ghostwriting. Quando un produttore farmaceutico riesce a indirizzare la stesura di un articolo è anche in grado di controllare, in gran parte, il modo in cui un risultato scientifico è compreso e usato dagli specialisti clinici e dai ricercatori.
Uno degli articoli più prestigiosi di Lindsay, pubblicato nel 2002 e in cui si dimostrano gli effetti benefici del Prempro su donne in postmenopausa, venne inizialmente redatto da DesignWrite, azienda che era stata ingaggiata da Wyeth per scrivere per conto terzi articoli destinati alla pubblicazione su riviste peer reviewed. Dopo aver incontrato Lindsay a metà aprile 2001 per discutere l’impostazione dell’articolo, DesignWrite elaborò una scaletta e la spedì a Lindsay (e Wyeth). DesignWrite spedì una bozza a Lindsay all’inizio di giugno per avere i suoi commenti, effettuò analisi aggiuntive e corresse il manoscritto. In agosto il «Journal of the American Medical Association» (JAMA) approvò la pubblicazione. Successivamente, nello stesso anno, DesignWrite modificò nuovamente l’articolo in risposta ai commenti ricevuti, e il lavoro fu pubblicato nel maggio 2002. Alla fine dell’articolo, Lindsay e i suoi tre coautori ringraziarono Karen Mittleman per il suo aiuto editoriale, senza dichiarare che la donna era una dipendente di DesignWrite o senza rivelare i suoi rapporti con Wyeth.
Lindsay nega che DesignWrite abbia avuto un ruolo di rilievo nella stesura dell’articolo del 2002 o di tutte le altre sue versioni. L’azienda, piuttosto, si sarebbe limitata a semplicemente a «fornire una bozza seguendo le nostre indicazioni» ha dichiarato lo scienziato. Insieme agli altri coautori citati nel lavoro, era responsabile della concezione e della direzione presa dallo studio. Se così fosse, Lindsay meriterebbe di essere citato come coautore e a Karen Mittleman non dovrebbe essere riservato nulla più che un breve riconoscimento, secondo quanto afferma Phil B. Fontanarosa, direttore esecutivo di «JAMA». «Non è chiaro se le attività di Mittleman abbiano incluso concezione e progettazione dello studio, acquisizione dei dati o la loro analisi e interpretazione», mi ha scritto Fontanarosa in una e-mail.
Questo uso di un’azienda esterna incaricata della stesura degli articoli non è stato un episodio isolato. Nel 2009 Kathleen Ohleth, che all’epoca lavorava per DesignWrite, ha aiutato Lindsay a scrivere un articolo per la rivista «Fertility and Sterility». (Dopo la mia intervista iniziale Lindsay si è rifiutato di rispondere a ulteriori domande, incluse quelle relative a chi ha pagato Ohleth nel 2009, e mi ha indirizzato a un addetto stampa). Anche due anni dopo, in un articolo pubblicato su «Osteoporosis International», Lindsay ha ringraziato Ohleth per la sua assistenza nella scrittura dell’articolo e ha ammesso che lo studio era stato finanziato da Pfizer (che nel 2009 aveva acquisito Wyeth), ma ha dichiarato di «essere l’unico autore responsabile della concezione e della direzione presa dal contenuto dell’articolo». In particolare l’articolo affermava che un gruppo di ormoni in fase di sviluppo presso Pfizer offriva «un nuovo paradigma per la terapia della menopausa».
Nello stesso periodo in cui Lindsay accettava l’aiuto redazionale di Pfizer, stringeva anche un gran numero di accordi di natura economica che ponevano un potenziale conflitto di interesse. Secondo una banca dati compilata dal gruppo di giornalismo investigativo ProPublica, nel 2009 e nel 2010 Eli Lilly ha dato aLindsay più di 124.000 dollari, la maggior parte dei quali per le sue prestazioni in qualità di conferenziere.
La maggior parte delle riviste peer reviewed ha regole precise riguardo alle dichiarazioni di rapporti di natura economica. Per la precisione, quello che uno scienziato deve rendere noto dipende dalla materia in oggetto e dalla rivista, quindi è difficile individuare con esattezza quando un ricercatore viola queste regole. Lindsay ha reso pubblici i suoi rapporti con Lilly in un gran numero di articoli, ma non lo ha fatto in modo uniforme. Per esempio, in un articolo che riguardava uno studio sull’osteoporosi, pubblicato nel settembre 2010 dalla rivista «Mayo Clinic Proceedings», molti degli autori hanno dichiarato di essere nello speakers bureau, o di avere altre forme di rapporto con l’azienda; Lindsay tuttavia, pure lui fra i coautori, non ha fatto alcuna dichiarazione in questo senso. In seguito mi ha detto che aveva cambiato idea riguardo alla dichiarazione di questo tipo di rapporti: «Fino a poco tempo fa le mie dichiarazioni includevano qualsiasi casa farmaceutica i cui prodotti sono citati nelle mie presentazioni» o negli articoli, ha spiegato. «Ho cambiato un po’ questa filosofia, perché ora, per garantire che ci sia una reale chiarezza, dichiarerei tutti i contatti».
La dichiarazione incoerente di Lindsay va ben oltre gli articoli. Come eminente ricercatore, ha avuto un ruolo chiave nella pubblicazione delle linee guida che altri medici usano per curare l’osteoporosi. Nel 2008, per esempio, ha contribuito a sviluppare e scrivere Clinician’s Guide to Prevention and Treatment of Osteoporosis, della statunitense National Osteoporosis Foundation. La guida, che è stata sottoscritta da numerose associazioni mediche, descrive le diverse opzioni terapeutiche, incluso il teriparatide. («Il teriparatide è in genere ben tollerato, sebbene alcuni pazienti avvertano crampi agli arti inferiori e vertigini», si legge). In un’apposita sezione la guida riporta che nessuno degli autori, Lindsay compreso, ha «un rapporto finanziario di rilievo con un qualsiasi interesse commerciale».Inoltre, apparentemente Lindsay ha omesso di citare questi potenziali conflitti quando ha fatto domanda per ricevere finanziamenti federali. Sebbene almeno dal 2004 fosse consulente di Lilly, nel 2005 ha chiesto agli NIH – l’agenzia statunitense responsabile della maggior parte della ricerca medica nazionale sostenuta dal governo federale – di finanziare uno studio sul Forsteo: Lindsay voleva effettuare biopsie di pazienti per vedere in che modo il farmaco incideva sulla loro struttura ossea. Ha ottenuto il finanziamento. Negli anni successivi gli NIH hanno finanziato gli studi di Lindsay sul farmaco con 3,4 milioni di dollari. Nel 2010 il ricercatore ha fatto domanda per un nuovo finanziamento per confrontare due modalità di somministrazione del Forsteo. Ancora una volta ha ottenuto il denaro, questa volta 364.000 dollari per il 2010 e ulteriori 345.000 dollari per il 2011.
I regolamenti federali sui potenziali conflitti di interesse nei finanziamenti erogati dagli NIH stabiliscono che chi riceve i fondi debba identificare qualsiasi conflitto di interesse reale o apparente, e dichiarare in che modo questi eventuali conflitti sono stati gestiti, ridotti o eliminati. Il mancato rispetto di queste norme è una violazione della legge. Sembra abbastanza chiaro, ma in pratica non lo è affatto. La responsabilità dell’applicazione dei regolamenti passa da un’istituzione all’altra, fino al punto che spesso conflitti come quello di Lindsay sfuggono dalle crepe del sistema.
Segui il denaro
Ogni anno gli NIH finanziano la ricerca medica con decine di miliardi di dollari. Con tutto questo denaro in gioco il rischio di corruzione è enorme. Gli NIH non sono molto abili nell’arrestare la corruzione, perché non sono sufficientemente aggressivi nello scoprire i conflitti di interesse dal lavoro dei propri scienziati. Quando li ho contattati nell’ambito di questa inchiesta per avere informazioni sulle potenziali falle nelle regole etiche, i funzionari degli NIH hanno serrato le fila.
Interrogato su possibili conflitti di interesse nei finanziamenti ricevuti da Lindsay per studiare il teriparatide, Faye Chen, funzionario degli NIH, si è rifiutato di fornire copie delle assicurazioni scritte dall’Helen Hayes Hospital, datore di lavoro di Lindsay – una documentazione richiesta delle leggi federali – in cui si affermava che i conflitti di interesse erano stati adeguatamente gestiti. Chen ha continuato ad affermare che era tutto in ordine. «L’impegno degli NIH è conservare la fiducia del pubblico sul fatto che le ricerche finanziate dall’agenzia sono condotte senza pregiudizi e secondo i più elevati standard scientifici ed etici», mi ha scritto in una email. E ha aggiunto: «Posso assicurarle che l’ente del Dr. Lindsay ha fornito le certificazioni richieste e le necessarie garanzie prima di ricevere il finanziamento, e che verrà chiesto loro di fornire questa certificazione ogni anno prima di ciascuna nuova assegnazione». I documenti ottenuti con una richiesta basata sul Freedom of Information Act non facevano cenno ad alcun potenziale conflitto di interesse, niente che indicasse che Lindsay riceveva denaro dal produttore del farmaco in fase di studio. I funzionari degli NIH non hanno rilasciato commenti sul fatto che avrebbero continuato o meno a seguire la questione.
Le azioni degli NIH non dovrebbero sorprendere. Alcuni anni fa l’ufficio dell’ispettorato generale del Department of Health and Human Services ha messo le mani su comunicazioni interne degli NIH in cui si scopre che i dirigenti scoraggiano le inchieste sui conflitti di interesse fra i ricercatori finanziati dagli NIH. (Nell’interesse della trasparenza: mia moglie lavora per l’ufficio dell’ispettorato generale, ma non ha nulla a che vedere con questi studi o con questo articolo.) Per esempio, un memorandum affermava: «Non dovremmo cercare ulteriori dettagli sulla natura del conflitto di interesse, o sul modo in cui è stato gestito, a meno che non ci sia una sufficiente preoccupazione programmatica che induca in questo senso».
Il caso di Lindsay non sembra isolato. In tutti gli Stati Uniti ci sono scienziati che conducono ricerche finanziate dal governo e contemporaneamente prendono denaro da case farmaceutiche, comportamento che spesso pone un potenziale conflitto di interesse. Per avere la percezione della quantità di denaro che dalle case farmaceutiche finisce nelle tasche di ricercatori che ricevono finanziamenti dagli NIH, ho sfruttato una banca dati che contiene tutti i finanziamenti erogati dagli NIH tra il 2009 e il 2010, e ho usato la banca dati ProPublica, che contiene i pagamenti delle case farmaceutiche, per identificare quali ricercatori fossero sul libro paga dei produttori di farmaci. Nel solo Stato di New York abbiamo identificato pagamenti per 1,8 milioni di dollari erogati da poche aziende a beneficiari di finanziamenti degli NIH: si trattava di pagamenti per prestazioni effettuate negli speakers bureau, per consulenze e altri servizi. (Probabilmente il totale dei finanziamenti dati a ricercatori dello Stato di New York è molto più grande). Molti di questi pagamenti potrebbero non creare alcun reale conflitto di interesse.
I ricercatori che ottengono un finanziamento dagli NIH non sono i soli a prendere denaro dalle case farmaceutiche: ci sono anche le persone che decidono quali ricercatori debbano ricevere i finanziamenti degli NIH. La banca dati ProPublica con cui ho identificato i pagamenti delle aziende a ricercatori finanziati dagli NIH mi ha anche permesso di individuare il flusso di denaro proveniente dalle aziende e diretto alle tasche dei membri delle commissioni consultive e di revisione e valutazione degli NIH. In questo modo abbiamo scoperto che 70 membri di commissioni consultive percepivano una somma superiore a un milione di dollari per partecipazioni a speakers bureau, consulenze e altri servizi prestati alle case farmaceutiche. Alcuni di questi pagamenti potrebbero violare le regole etiche federali, che vietano ai membri delle commissioni consultive di partecipare a decisioni che potrebbero influire su un’organizzazione dalla quale ricevono cospicue remunerazioni.
Il problema, dunque, non si limita ai ricercatori che ricevono i finanziamenti degli NIH. Il denaro proveniente dalle case farmaceutiche si è infiltrato negli stessi NIH. Se l’agenzia fosse a conoscenza dei potenziali conflitti d’interesse dei suoi dipendenti e non facesse nulla per garantire che questi conflitti non incidano sulle decisioni dei comitati, violerebbe la legge. Per scoprirlo ho compilato una richiesta secondo il Freedom Information Act chiedendo di consultare la documentazione che indicava se gli NIH sapessero, o meno, di pagamenti delle case farmaceutiche ai membri dei propri comitati e, in caso di risposta affermativa, se consentissero ai beneficiari di quei pagamenti di svolgere le proprie mansioni nonostante fossero sul libro paga di un produttore di farmaci. Gli NIH si sono rifiutati di consegnare questi documenti. Li ho citati in giudizio, e dopo una causa durata nove mesi un giudice federale ha costretto l’agenzia a rilasciare tutto ciò che aveva cercato di tenere nascosto.
Alcuni dei documenti ottenuti grazie al procedimento legale implicano che la politica interna degli NIH sul conflitto di interesse è in gran parte dedicata a scoprire moduli mancanti. Inoltre, da questi documenti sembrerebbe che diversi istituti degli NIH non abbiano mai avviato neppure una singola azione di sostegno all’applicazione di norme contro il conflitto di interesse nei confronti dei propri impiegati fin dal 2008. Eppure i documenti più significativi, quelli che gli NIH hanno cercato disperatamente di tenere nascosti, hanno a che fare con quelli che sono definiti «accordi (o atti) di rinuncia».
In circostanze limitate, gli NIH possono concedere un atto di rinuncia, ovvero un atto che esenta un impiegato governativo in conflitto (per esempio un membro di un comitato consultivo) dal rispetto di norme etiche. Ho chiesto informazioni sugli accordi di rinuncia che erano stati concessi a diversi membri dei comitati consultivi degli NIH, persone che conoscevo dalla banca dati ProPublica e da altre fonti, e che avevano ricevuto migliaia di dollari dalle case farmaceutiche. Volevo scoprire perché gli NIH permettevano a queste persone di far parte di comitati nonostante un potenziale conflitto e, informazione altrettanto importante, quale fosse la natura di questi conflitti.
La maggior parte dei pagamenti provenienti dalle case farmaceutiche non era citata in quei documenti. Per esempio LouisPtàcek, che all’epoca era membro del National Advisory Neurological Disorders and Stroke Council, aveva ottenuto il permesso di partecipare a un certo numero di riunioni, nonostante possedesse numerose azioni di case farmaceutiche, ma l’atto di rinuncia non citava il fatto che avesse ricevuto oltre 50.000 dollari da Pfizer in qualità di consulente. (Ptàcek non ha risposto a una richiesta di commento sulla faccenda.) Analogamente un atto di rinuncia per Arul Chinnaiyan, che fa parte del comitato scientifico del National Cancer Institute, non ha reso noto negli atti il fatto che avesse ricevuto 9000 dollari nel 2009 e 21.000 dollari nel 2010 da GlaxoSmithKline. Ma Chinnaiyan ha detto di aver comunicato questi accordi agli NIH. Perché, allora, non sono stati citati nel suo atto di rinuncia?
Gli NIH non hanno fatto commenti su casi individuali. Un funzionario dell’agenzia ha accettato di parlare della politica generale, ma solo a condizione di non essere nominato. In generale i compensi per le prestazioni di consulenza e per gli accordi degli speakers bureau, mi ha spiegato questa persona, non sono inseriti in un atto di rinuncia, ma in un documento separato che tratta di problematiche specifiche relative a quali membri del comitato debbano astenersi dalle proprie funzioni a causa di conflitti di interesse. Quando questo articolo è andato in stampa Susan Cornell, funzionario del Freedom of Information Act presso gli NIH, ha confermato che l’agenzia non era riuscita a consegnare documenti riguardanti alcune astensioni per conflitto di interesse in risposta alla mia richiesta basata sul Freedom of Information Act, come invece avrebbe dovuto fare.
La divulgazione incoerente di documenti da parte degli NIH e la segretezza che li circondava hanno reso impossibile stabilire con certezza che cosa stava accadendo. Come minimo, nel controllare i potenziali conflitti, gli NIH fanno un lavoro approssimativo. Per esempio, se accordi di consulenza appartengono a un documento di astensione, come mai gli accordi di consulenza stipulati fra Lawrence R. Stanberry e GlaxoSmithKilne compaiono sui suoi atti di rinuncia? (Stanberry, direttore del Dipartimento di pediatria del College of Physicians and Surgeons della Columbia University, siede nel comitato dei consulenti scientifici del National Institute of Allergy and Infectious Diseases). E come mai la rinuncia non include il lavoro di consulenza che Stanberry ha svolto per conto di Sanofi-Pasteur? «Non so perché la consulenza a Sanofi-Pasteur non è stata inserita nella rinuncia», mi ha scritto Stanberry in una e-mail. Forse i funzionari incaricati di produrre i documenti relativi alla rinuncia hanno fatto degli errori.
Applicare le regole: il gioco delle tre carte
Le informazioni ottenute con un’altra richiesta sempre secondo il Freedom of Information Act, questa volta presentata all’Office of the Government Ethics – l’agenzia incaricata di garantire che le agenzie governative come gli NIH seguano le regole etiche – implicano che gli NIH non rispettano le regole federali sugli atti di rinuncia.
Dal punto di vista del governo, concedere una rinuncia è una questione seria; sostanzialmente significa garantire l’immunità da una legge, ed è un provvedimento che dovrebbe essere attuato soltanto di rado e con una supervisione rigorosa. Le regole federali impongono che gli NIH debbano confrontarsi con l’Office of the Government Ethics prima di concedere questi privilegi. Negli ultimi anni gli NIH hanno rilasciato decine di rinunce simili a favore di membri dei comitati consultivi, ma dal 2005 l’ufficio etico ha documentato solo tre episodi in cui gli NIH si sono consultati con l’ufficio, come richiesto, e nessuna delle rinunce in questione riguardava un membro di un comitato consultivo. Ho chiesto spiegazioni a funzionari dell’agenzia, i quali hanno risposto che gli NIH erano perfettamente in linea con i regolamenti federali nei casi in cui si trattava di rilasciare atti di rinuncia, ma non hanno fornito prove del fatto che l’agenzia si consultava con l’Office of the Government Ethics quando rilasciava queste rinunce, come richiesto dalla legge.
Le istituzioni che gestiscono finanziamenti dovrebbero fornire un ulteriore controllo sul conflitto di interesse, ma in realtà non lo fanno. Storicamente gli NIH non si sono assunti la responsabilità di controllare i conflitti di interesse nelle ricerche che finanziano. Nel 2007, in risposta a un reclamo dell’Office of Inspector General riguardo il fatto che la gestione dei conflitti di interesse da parte dei National Institutes of Health era tragicamente inadeguata, Elias Zerhouni, che allora dirigeva l’agenzia, ha dichiarato che non era compito degli NIH stabilire se i beneficiari dei suoi finanziamenti rispettavano le leggi etiche. «Riteniamo che sia fondamentale mantenere l’obiettività nelle ricerche», ha scritto in una lettera all’Office of Inspector General, «tuttavia le responsabilità per l’identificazione dei conflitti di interesse di natura finanziaria devono rimanere a carico degli istituti per cui lavorano i beneficiari dei finanziamenti». I funzionari degli NIH affermano che la politica non è cambiata.
E tuttavia anche gli istituti dei beneficiari hanno esempi di casi in cui non sono stati affrontati problemi di natura etica che coinvolgevano i loro ricercatori. Un rapporto del 2009 dell’Office of Inspector General ha analizzato il modo in cui le organizzazioni che ricevono finanziamenti dagli NIH scoprono potenziali conflitti di interesse. Il 90 per cento lasciava alla discrezione del ricercatore l’identificazione di qualsiasi problema. Addirittura le istituzioni che sposano pubblicamente una linea dura contro i conflitti di interesse sono spesso deboli nell’imporre le proprie politiche. Alla fine del 2010 ProPublica ha utilizzato la propria banca dati di case farmaceutiche per controllare la Stanford University e diverse altre università con solide politiche contro il conflitto di interesse, scoprendo che decine di docenti percepivano denaro da queste aziende in violazione delle regole delle istituzioni di appartenenza.
L’Helen Hayes Hospital, dove lavora Lindsay, non sembra far rispettare rigorosamente le regole. Senza dubbio l’organizzazione è complessa, è una struttura statale, dunque il Department of Health dello Stato di New York ha diversi interessi in gioco, e tutti i suoi finanziamenti sono gestiti attraverso la Health Research Inc., organizzazione no-profit che aiuta il Department of Health a ottenere fondi esterni per la ricerca medica. Health Research Inc. gestisce mezzo miliardo di dollari all’anno di finanziamenti. Tuttavia è sorprendente il fatto che con così tanti fondi e tanto denaro in gioco Health Research Inc. non scopra numerosi casi di conflitti di interesse ogni anno. «Ho lavorato qui come direttore di programmi sponsorizzati per 11 anni, e sono stato dipendente di Health Research Inc. nell’ufficio che amministrava i fondi per 17 anni. Non ho mai visto un conflitto di interesse», mi ha detto Terry Dehm, di Health Research Inc. «Non un singolo conflitto di interesse in nessuno dei finanziamenti per i quali abbiamo fatto richiesta… Semplicemente, non ne abbiamo mai visti».
Quando le ho spiegato che il finanziamento ricevuto da Lindsay dagli NIH per studiare Forsteo, finanziamento gestito da Health Research Inc., attirava anche denaro dal produttore del farmaco che Lindsay stava studiando grazie a fondi federali, Dehm mi ha risposto che il direttore esecutivo di Health Research Inc., MichaelNazarko, mi avrebbe chiamato quel pomeriggio o il giorno dopo. Non lo ha mai fatto, né ha mai risposto ai ripetuti tentativi di far seguito alla questione. Alla fine, tramite un addetto stampa del Department of Health di New York, Nazarko si è rifiutato di rispondere a qualsiasi domanda, e lo stesso hanno fatto Val Gray, amministratore delegato dell’Helen Hayes Hospital, e Felicia Cosman, direttore delle ricerche cliniche all’Helen Hayes Hospital. Secondo ProPublica, Cosman ha ricevuto finanziamenti dagli NIH per studiare il farmaco Forsteo nonostante avesse ottenuto 135.000 dollari da Eli Lilly per tenere conferenze e per consulenze. Quando ho chiesto un commento, Helen Hayes Hospital e HRI mi hanno spedito per e-mail una copia delle loro politiche sul conflitto di interesse e un comunicato in cui si affermava che, con entrambi i finanziamenti di Lindsay e Cosman, «le procedure descritte nel documento sulle politiche aziendali contro il conflitto di interesse erano state rispettate».
Qualche giorno dopo una mia telefonata all’Helen Hayes Hospital per chiedere informazioni sul lavoro di Lindsay e su potenziali conflitti di interesse, sono stato contattato da funzionari dell’ospedale per effettuare una revisione etica del lavoro di Lindsay. All’inizio l’ospedale ha cercato di trovare una commissione indipendente per esaminare se nel lavoro di Lindsay ci fossero conflitti a causa dei suoi rapporti con Lilly. Tuttavia, visto che la ricerca era vana, alla fine l’ospedale avevo deciso di chiedere al proprio Institutional Review Board (IRB) di dare un’occhiata. (Lindsay è membro di questa commissione, ma non ha partecipato alle discussioni). L’Institutional Review Board ha scoperto che Lindsay aveva ricevuto significative somme di denaro da Lilly, ma che questi compensi non ponevano alcun conflitto di interesse. Sono venuto a conoscenza di questi procedimenti nei mesi successivi, dopo aver fatto ricorso alla New York State’s Freedom of Information Law per informarmi su documenti relativi ai finanziamenti. Purtroppo un IRB – che viene istituito per approvare i protocolli di ricerca in un trial clinico e garantire che i pazienti vengano curati in modo appropriato – è mal equipaggiato per rispondere a domande sui conflitti di interesse di natura finanziaria. «La composizione di un IRB non è stata pensata per gestire conflitti di interesse nel mondo di oggi», dice Arthur Caplan, del Langone Medical Center della New York University (nonché membro del comitato scientifico di «Scientific American»), uno dei maggiori esperti di bioetica al mondo: «È abbastanza chiaro che questa persona all’Helen Hayes Hospital ha un grave conflitto di interessi», dice Caplan. Carl Elliott, dell’Università del Minnesota, concorda. «L’IRB non era l’organo giusto a cui chiedere un’opinione», mi ha scritto in un’e-mail. In ogni caso, l’Helen Hayes Hospital non è attrezzato per eliminare alla radice i conflitti. Gli avvocati dell’ospedale si sono adattati al linguaggio standard delle linee guida dei finanziamenti degli NIH, che, fra le altre cose, chiedono a un ricercatore di riferire «qualsiasi fatto collegato con interessi finanziari, in denaro o in altro genere di benefici, ricevuti dallo sponsor di una ricerca (per esempio gettoni di consulenza, onorari, viaggi, pasti o divertimenti)». (Il corsivo è stato aggiunto per enfatizzare.) La clausola inserita restringe l’ambito di quello che deve essere dichiarato. Visto che Lilly non è lo sponsor delle ricerche di Lindsay, ma lo sono gli NIH, in base a queste linee guida i pagamenti effettuati dall’azienda non sembravano rientrare nel conflitto di interesse.
Di fatto, è difficile evocare una circostanza in cui il beneficiario di un finanziamento degli NIH possa avere un conflitto di interesse sulla base di regole stabilite dall’Helen Hayes Hospital. Non c’è ragione di pensare che l’ospedale sia speciale in questo contesto. Le istituzioni che gestiscono fondi non hanno uno stimolo reale per preoccuparsi dei conflitti. Tanto più denaro da finanziamenti ricevono i loro dipendenti, tanto meglio è per i dipendenti stessi. Perché preoccuparsi?
Aggiustare il sistema
I ricercatori non possono frenare l’influenza del denaro che proviene dalle case farmaceutiche. Gli ospedali e le università non lo faranno. Gli NIH si rifiutano di farlo. Come risultato, milioni di dollari provenienti dai contribuenti finanziano ricerche la cui obiettività è sospetta. Il Parlamento degli Stati Uniti, che tiene i cordoni della borsa, è fuori di sé. La maggior parte delle sue ire è diretta agli NIH, che ha anche richiamato per il fatto di non seguire le linee guida etiche. «Per gli anni che ho trascorso come presidente di questo sotto-comitato, conosco fin troppo bene l’atteggiamento che spesso caratterizza gli NIH: queste regole non si applicano alla nostra agenzia», ha detto nel 2004 Joe Barton, delegato del Texas, all’epoca presidente dell’House Energy and Commerce Committee, in un’audizione sulle mancanze etiche degli NIH. «Ci si può solo chiedere: se gli NIH possono essere così permissivi sulle regole etiche più fondamentali del governo federale, che cosa deduciamo a proposito della loro capacità di gestire i denari dei contribuenti e, soprattutto, di garantire che la ricerca finanziata dai contribuenti venga tradotta in cure?», ha aggiunto. Eppure l’atteggiamento continua anche dopo che il Parlamento ha esercitato una pressione maggiore sugli NIH affinché si rimettano in carreggiata.A partire dal 2008 Charles Grassley, senatore dell’Iowa, ha avviato una serie di interrogazioni parlamentari relative ad alcuni episodi in cui i beneficiari di fondi degli NIH hanno omesso di dichiarare pagamenti ricevuti dalle case farmaceutiche e in cui le università hanno fallito nel punire adeguatamente i ricercatori coinvolti. L’esempio più clamoroso riguarda il caso di Charles Nemeroff, che fino a poco tempo fa era direttore del Dipartimento di psichiatria alla Emory University. I documenti della Emory mostravano che già nel 2000 c’erano problemi sull’opportunità da parte di Nemeroff di avere legami con l’industria, come quelli relativi al denaro che riceveva dalla casa farmaceutica Smith-Kline Beecham, che in seguito sarebbe diventata GlaxoSmithKline. (L’azienda aveva anche donato denaro per sovvenzionare una cattedra nel dipartimento di Nemeroff.)
Nel 2003 i ricercatori hanno accusato Nemeroff di non aver dichiarato i propri legami con i produttori di tre trattamenti di cui riferiva un articolo pubblicato da «Nature Neuroscience».Come risposta, la Emory ha avviato un’inchiesta. Nel 2004 l’università ha stabilito che Nemeroff era, di fatto, coinvolto in «molti casi di violazione del conflitto di interesse, consulenza e altre politiche». Messo di fronte a queste scoperte, Nemeroff ha accettato di ridurre le proprie consulenze con GlaxoSmithKline a causa delle implicazioni che avrebbero potuto avere per un progetto finanziato dagli NIH su cui stava lavorando, e ha anche accettato di ridurre i rapporti con diverse altre aziende. Dopo che nel 2008 un’inchiesta del Parlamento ha nuovamente portato alla luce un altro conflitto di interesse, Nemeroff si è dimesso da direttore del Dipartimento di psichiatria e la Emory University gli ha vietato per due anni di chiedere finanziamenti sponsorizzati dagli NIH. Da allora Nemeroff ha lasciato la Emory per l’Università di Miami, dove è attualmente preside della Facoltà di psichiatria e scienze comportamentali e responsabile di una nuova ricerca finanziata con 400.000 dollari dagli NIH.
Dopo queste indagini parlamentari, gli NIH hanno adottato nuovi ordinamenti in base a cui i beneficiari dei finanziamenti devono dichiarare agli istituti di appartenenza ogni rapporto finanziario che supera i 5000 dollari. Oltre a ciò, le regole impongono alle istituzioni di fornire una spiegazione pubblica, per sommi capi, di ogni conflitto di interesse del personale coinvolto in ricerche finanziate dagli NIH. Questi cambiamenti implicano che il pubblico avrà accesso a una maggiore quantità di informazioni sui bersagli del denaro proveniente dalle case farmaceutiche. Francis Collins, direttore degli NIH, ha elogiato i nuovi regolamenti definendoli «un messaggio inequivocabile del fatto che gli NIH sono impegnati a promuovere l’obiettività nelle ricerche che finanziano». Comunque, nel nuovo regolamento non c’era alcun cambiamento su chi fosse responsabile dell’individuazione di questi conflitti o della gestione dei problemi etici. «Dato che le istituzioni conoscono il contesto in cui lavorano i loro dipendenti, e dato che queste persone sono dipendenti di istituti di ricerca e non del governo, la responsabilità della gestione spetta a loro», dice Sally Rockey, vice direttore degli NIH per le ricerche extra moenia. «Le istituzioni si trovano nella posizione migliore per gestire gli interessi finanziari dei loro impiegati».L’unica speranza di risolvere il problema dei conflitti di interesse nella scienza risiede negli scienziati stessi. La cultura della scienza può cambiare. Attraverso le riviste peer reviewed (la cui reputazione soffre a causa di una ricerca minata da preconcetti) e attraverso le accademie scientifiche (che stabiliscono standard etici che gli scienziati dovrebbero osservare), i ricercatori possono esercitare pressioni sui loro colleghi affinché rinuncino al denaro delle case farmaceutiche. Come minimo, potrebbero convincerli che è nel loro interesse a lungo termine essere trasparenti sui pagamenti che ricevono dalle aziende. La speranza di fornire una direzione etica e di esercitare una pressione fra pari è rappresentata dalle organizzazioni professionali e dalle riviste peer reviewed. Nel settore di Lindsay, questi attori sarebbero la National Osteoporosis Foundation e «Osteoporosis International». Ma queste organizzazioni hanno intenzione di assumere il comando nell’azione mirata all’eliminazione dei conflitti di interesse e sono in grado di farlo? Una persona alla quale porre questa domanda potrebbe essere l’ex presidente della National Osteoporosis Foundation, l’attuale direttore di «Osteoporosis International»: Robert Lindsay.
PER APPROFONDIRE
Banca dati ProPublica citata nell’articolo: http://projects.propublica.org/docdollars.
Università della California a San Francisco, banca dati di documenti dell’industria farmaceutica: http://dida.library.ucsf.edu.
Banca dati finanziamenti NIH: http://projectreporter.nih.gov/reporter.cfm?icde=
Rapporto dall’audizione Grassley-Baucus al Senato: www.finance.senate.gov/hearings/hearing/?id=dc6efa3a-e47a-86db-2281-bf16970558e6.
FONTE: Le scienze, numero 534, febbraio 2013
Questo opera è distribuito con licenza Creative Commons Attribuzione – Non commerciale – Condividi allo stesso modo 3.0 Italia.