L'alba del pianeta delle scimmie. Non è necessario che la fantascienza diventi realtà ogni volta...
L’argomento è spinoso, il dibattito è aperto e vivace più che mai. Come molti possono immaginare, nel mondo ipertecnologicamente avanzato in cui viviamo, dove la scienza ha compiuto enormi progressi in tutte le direzioni, non è più possibile rassegnarsi al fatto che la sperimentazione animale sia ancora del tutto insostituibile.
Non è una questione di soldi, anzi come vedremo l’impegno economico per l’impiego di cavie per testare un farmaco è molto elevato, ma secondo una gran folla di eminenti esperti, seppur loro malgrado, ancora non esistono alternative valide alle sperimentazioni in vivo in quanto esse rappresentano l’unica opportunità per apprendere e confermare l’efficacia di una nuova molecola.
Infatti, come sostiene Derek Lowe, per tutto ciò che sappiamo sulla biochimica, sulla fisiologia e per quanto riguarda la biologia in generale, i sistemi viventi sono ancora troppo complessi per noi da semplificare con un modello. Siamo molto più ignoranti di quanto sembriamo.
Questo tuttavia non significa affatto che non sia possibile immaginare un miglioramento…

Scoperta e primi test, dalla durata variabile da 1 a 3 anni, in cui si inizia a delineare una necessità farmacologica studiando la malattia per determinare come il farmaco possa intervenire e le sue possibili interazioni. In questa fase è possibile considerare fino a 30.000 composti chimici come potenziali candidati, implicando approfondimenti di farmacodinamica e farmacocinetica. In estrema sintesi, sfruttando le parole di Leslie Z. Benet, è possibile definire la prima come l’effetto (o gli effetti) che il farmaco induce in un organismo, mentre la seconda rappresenta l’effetto che l’organismo impone ad un farmaco. Naturalmente queste due discipline complementari sono di gran lunga più complesse, ma questa non è la sede adatta per un ulteriore approfondimento, al quale vi rimando alle rispettive e più esaurienti voci di Wikipedia. Quello che è necessario sapere è che la tossicità di ogni farmaco viene determinata usando almeno due specie animali, tra le quali una appartiene sempre all’ordine Rodentia (volgarmente detti roditori) con i quali si osservano gli effetti di dosi singole e multiple con diversi metodi di somministrazione. Un trial di un paio di settimane con i ratti ha un costo stimato di circa 200.000 euro.
La revisione di sicurezza è la fase successiva in cui le case farmaceutiche tentano di ottenere le autorizzazioni necessarie per la sperimentazione clinica sull’uomo. Tutte le informazioni raccolte nella fase precedente devono essere presentate agli organi competenti, incluse le metodiche di sintesi previste per la produzione. Durante questa fase che dura un mese o poco più, si tenta inoltre di brevettare il farmaco, con costi dell’ordine di qualche decina di migliaia di euro cadauno.
Lo studio clinico dalla durata variabile da 2 a 10 anni, consiste nella somministrazione in soggetti umani dei circa 100-200 principi attivi che hanno superato la prima fase di selezione e si suddivide in ulteriori livelli progressivi che hanno lo scopo di selezionare ulteriormente i candidati farmacologici determinandone la sicurezza, la tollerabilità, gli effetti collaterali, ecc. Al termine del trial clinico solo il 4-10% dei composti chimici iniziali superano con successo l’osservazione.
L’approvazione finale potrebbe richiedere anche un’attesa di sette anni, giustificata dalla determinazione dell’effettiva sicurezza ed efficacia che la vendita al pubblico di un nuovo farmaco giustamente necessita.
In tutto questo lungo e dispendioso processo per la ricerca e lo sviluppo di nuovi farmaci, la sperimentazione animale sembrerebbe davvero un passaggio fondamentale, dal quale dipende la solidità stessa della ricerca e i motivi sono molteplici e intuibilmente dipendenti dai grandi interessi che entrano in gioco, oltre alla consolidata attendibilità che i modelli basati sull’impiego di animali sembrerebbero assicurare.
Il motivo per il quale è raccomandabile l’uso del condizionale, può essere ricercato anche nella storia recente della farmacopea. Eclatante infatti è stato il caso della reboxetina, un antidepressivo che ha superato con successo la sperimentazione animale, ma che in seguito ha rivelato tutta la sua fallacia, in quanto sebbene dimostrasse efficacia in tutti i modelli animali considerati, una metanalisi successiva sui dati clinici ha stabilito la sua totale inefficacia sull’uomo oltre ad una sostanziale pericolosità, elementi per i quali il ritiro dal commercio e l’interruzione dei promettenti studi relativi a nuove possibilità terapeutiche sono stati inevitabili.
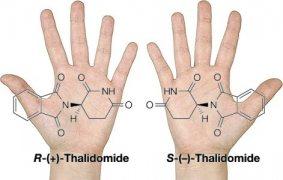
I due enantiomeri della talidomide.
Un richiamo alla tristemente nota talidomide è altrettanto inevitabile. Negli anni cinquanta del secolo scorso, dopo ben 3 anni di prove condotte su animali, fu messo in commercio e destinato in particolare alle donne in gravidanza, nonostante non fosse mai stato testato prima su animali gravidi. La somministrazione del farmaco si rivelò disastrosa, e numerosi casi di neonati con gravi malformazioni videro la luce. Inizialmente si pensò che il problema dipendesse da una certa impurezza nella sintesi molecolare. Infatti il 2-(2,6-diosso-3-piperidinil)-1H-isoindol-1,3(2H)-dione è una molecola chirale, ovvero può esistere nelle due forme racemiche (enantiomeri) caratterizzate da una somiglianza di tipo speculare, la stessa somiglianza che impedisce la sovrapposizione completa delle nostre mani. Solo in seguito si comprese che anche isolando lo stereoisomero (R), in vivo esso si converte con un meccanismo complesso (racemizzazione) nella forma (S), pericolosamente teratogena.
Quello che risulta chiaro è che esiste una seria controversia scientifica sull’effettivo potere predittivo dei modelli animali nei confronti dei farmaci e delle malattie. Tralasciando gli innumerevoli abusi di cui alcuni rami deviati della comunità scientifica si è macchiata, come ad esempio il caso Britches o quello delle scimmie di Silver Spring, è innegabile che gli animali rappresentino dei formidabili bioreattori in grado di fornire molte delle risposte utili alla ricerca farmaceutica. Tuttavia questo non può mai essere sinonimo di sicurezza in quanto non tiene conto di differenze qualitative e quantitative, oltre alle evidenti differenze evolutive che distinguono gli esseri umani dagli altri animali, come ben noto nella pratica tossicologica.
Infatti se consideriamo la tossicità del fenolo, scopriremo che umani e ratti lo espellono con due percorsi distinti: coniugazione del solfato e coniugazione dell’acido glucuronico. Esiste una differenza quantitativa tra i due percorsi negli umani e nei ratti, in quanto il rapporto fra i due percorsi è sostanzialmente diverso in ciascuna specie. Inoltre esistono anche differenze qualitative, ad esempio i gatti sono incapaci di coniugare l’acido glucuronico e la via del solfato risulta esclusiva. Per i suini è vero il contrario, e non è trascurabile il fatto che per i primati esistono almeno sette altre vie metaboliche, come quella basata sull’acido chinico. Ne consegue che anche se la stessa funzionalità accomuna due specie (come l’eliminazione del fenolo), il meccanismo che soggiace non è necessariamente identico e nel contesto tossicologico (e farmacologico) queste differenze risultano fondamentali per garantire l’assoluta sicurezza e utilità del farmaco.
Si potrebbe obiettare che non bisognerebbe criticare i modelli animali a meno di non fornire alternative migliori per la ricerca, ma, per fare un’analogia infelice, nemmeno la fallace predittibilità dell’astrologia possiede alternative, tuttavia nessuno si lamenta quando ciò viene sostenuto. Probabilmente ciò su cui bisogna ragionare è l’attendibilità della previsione stessa, tenendo conto che sembrerebbe logico iniziare un approccio intraspecie piuttosto che interspecie, oltre alla vera consapevolezza che la complessità del problema non si riduce semplicemente utilizzando un modello abbastanza complesso.
A questo punto però, rimangono da esplorare le alternative proposte dai detrattori della sperimentazione animale, che esistono davvero anche se non godono della stessa popolarità tra i ricercatori, nonostante il fatto che inizino a comparire tra le priorità eticamente imposte dalle 3 R.


Pelle sintetica
Fra le alternative più in voga, troviamo la pelle sintetica che viene già impiegata con successo nei trapianti degli ustionati gravi. Essa rappresenta uno degli organi più estesi dell’essere umano e può essere coltivata in laboratorio con relativa facilità, infatti sempre più spesso viene sfruttata per l’esecuzione di test per la compatibilità farmacologica, nel conseguimento di sistemi diagnostici in vitro sempre più attendibili e performanti.
I modelli computerizzati (in silico) hanno ormai raggiunto prestazioni eccellenti, anche se sono ancora in rapido e costante progresso, come già in precedenza ho riportato in un esempio. Questi in congiunzione con la progettazione statistica avanzata, potrebbero rappresentare la vera chiave di Volta per una sofisticata simulazione del metabolismo, della farmacodinamica e relativa cinetica, in modo da ottemperare alle prescrizioni che le 3 erre propongono.
La scienza ad accesso aperto costituisce il più illuminato mezzo a nostra disposizione per accelerare la ricerca. L’impatto potenziale di un approccio open sull’industria farmaceutica non è da sottovalutare. Sebbene per questo soggetto esista un certo interesse nei confronti dell’open innovation, forse incentivato anche dalla recente crisi, non è ancora del tutto chiaro che i progressi e la scienza devono essere diffusi e condivisi con il mondo esterno. Qualche timido e virtuoso esempio è rappresentato da Altweb, the Alternatives to Animal Testing Web Site, un progetto del Johns Hopkins School of Public Health creato per servire da portale ricco di news, informazioni e risorse online sulle alternative disponibili.
Le domande che emergono sono ancora molte. Chi sosterrà la ricerca di base necessaria all’implementazione di queste alternative? Chi si occuperà di regolamentare la condivisione della ricerca sostenendo principalmente la pubblicazione dei risultati in regime di open access in modo da soddisfare il necessario aggiornamento che gli enti regolatori necessitano, insieme ai centri di ricerca ed a tutta la comunità scientifica coinvolta? E ancora: gli sforzi dell’open access possono davvero fornire un’alternativa complementare al processo tradizionale per la ricerca farmaceutica?
Anche se le risposte non sono ancora disponibili, vale sempre la pena di approfondire. I posteri ne gioveranno…
Fonti:
Animal Testing: A View From the Labs
Pharmaceuticals-How Are They Produced?

Shanks, N., Greek, R., & Greek, J. (2009). Are animal models predictive for humans? Philosophy, Ethics, and Humanities in Medicine, 4 (1) DOI: 10.1186/1747-5341-4-2
Kapetanovic, I. (2008). Computer-aided drug discovery and development (CADDD): In silico-chemico-biological approach Chemico-Biological Interactions, 171 (2), 165-176 DOI: 10.1016/j.cbi.2006.12.006
Woelfle, M., Olliaro, P., & Todd, M. (2011). Open science is a research accelerator Nature Chemistry, 3 (10), 745-748 DOI: 10.1038/nchem.1149