Fonte: In Opposizione alla Sperimentazione Animale | leggi l’articolo originale (>>)
Articolo in lingua originale: http://animalexperiments.info/resources/Studies/Alternatives/Replacement.-Langley-et-al.-2007./Replace-Langley-et-al-2007-Bioessays.pdf
Sommario

Introduzione
La preoccupazione del pubblico per gli esperimenti sugli animali ha una lunga storia e si è intensificata negli ultimi due decenni. Le preoccupazioni si concentrano principalmente sulle sofferenze causate ad animali senzienti sia durante gli esperimenti che nell’isolamento in un laboratorio. I critici sottolineano inoltre che la validità degli esperimenti su animali è spesso ipotizzata piuttosto che provata e che essi esigono alti costi e tempi lunghi. Le linee di condotta sulla ricerca animale che regolano il finanziamento sia pubblico che scientifico rimangono vaghe e si sta invertendo la trentennale tendenza al ribasso del numero degli esperimenti.
Una soluzione fondamentale è lo sviluppo di metodi di ricerca e test originali o adattati che possano prendere il posto degli esperimenti sugli animali e non solo evitarne l’uso. Lo sviluppo di tecniche di sostituzione, incluso nella nozione accettata internazionalmente delle Tre R (rimpiazzare, ridurre e rifinire), non è nè nuovo nè non sperimentato: dal 1986, le legislazioni nazionale (Regno Unito, ndt) ed Europea richiedono che tecniche equivalenti non animali debbano essere usate al posto di esperimenti sugli animali. Negli USA una restrizione analoga opera a livello istituzionale. Nell’ Unione Europea, la Commissione e gli stati membri si impegnano ad incoraggiare la ricerca secondo modalità che possano raggiungere gli stessi scopi ma usando meno animali o nessuno. Per questa ragione nel 1991 è sorto il Centro europeo per la convalida dei metodi alternativi (European Centre for the Validation of Alternative Methods – ECVAM), che ha avvalorato con successo più di 18 metodi di sostituzione completa o parziale, otto dei quali hanno già conquistato accettazione normativa.
Il governo britannico si è fatto promotore delle Tre R fondando nel 2004 il ‘Centro Nazionale per il Rimpiazzo, Riduzione e Rifinimento (dell’uso) degli animali nella ricerca’, il cui scopo finale è la sostituzione di tutti gli esperimenti sugli animali. Esistono simili centri in Germania, Austria, Paesi Bassi, Giappone e in altri luoghi. È crescente il consenso sul fatto che i metodi di ricerca senza animali siano tecniche avanzate, che hanno il potenziale di migliorare il progresso medico e scientifico con spese minori e in meno tempo. Come ha affermato il governo britannico, i metodi alternativi sono spesso in realtà, “(…) ‘metodi avanzati’ che ampliano la portata e sormontano alcune limitazioni dei modelli animali esistenti”.
In questo resoconto discutiamo le origini e le applicazioni di alcuni metodi di sostituzione di successo già usati nella ricerca medica fondamentale e in test normativi, osservando tre campi di ricerca (sepsi, malattie respiratorie e dolore) come occasioni per sostituire ulteriormente gli esperimenti con animali e di avere sviluppi futuri.
Sostituire le procedure con animali
La sostituzione delle procedure animali è un’idea ben radicata nell’industria, soprattutto nei settori farmaceutici, chimici e cosmetici, ma sembra molto meno conosciuta nell’ambiente universitario. Gli esperimenti sugli animali condotti dall’industria in Gran Bretagna sono significativamente diminuiti per diversi anni, ma quelli eseguiti nelle università e scuole di medicina sono aumentati del 52% nell’ultimo decennio. I riusciti esempi di sostituzione che seguono sono stati selezionati fra i molti, per illustrare diversi percorsi e ragioni per lo sviluppo e l’attuazione di metodi di sostituzione.
Test sulla regolamentazione dei medicinali e prodotti chimici
La sicurezza o la qualità dei test di farmaci o di sostanze chimiche sono aree dove la sostituzione dei metodi basati sugli animali è molto diffusa, sia nel settore industriale che fra le autorità di regolamentazione.
In ambito normativo , i nuovi test sono convalidati con un processo formale concordato a livello internazionale. Diverse tecniche sostitutive sono state convalidate ed approvate con successo. Dal 2000, tre metodi in vitro o sintetici hanno ottenuto accettazione a livello normativo per testare la corrosività chimica: l’analisi di pelle di ratto e di modelli di pelle umana e il modello Corrositex hanno sostituito violenti test in vivo su conigli. Il saggio di assunzione del rosso neutro con cellule per la fotosensibilità è accettato internazionalmente, evitando test sui topi. I dati provenienti dal metodo in vitro che stima la penetrazione cutanea di farmaci, pesticidi e sostanze chimiche sono internazionalmente accettati, sostituendo molti studi sui topi. Nel 2007 l’ECVAM ha approvato due test in vitro su modelli di pelle umana come sostituti per test in vivo di irritazione cutanea sui conigli.
Altre tecniche sono state validate scientificamente e sono in cantiere normativo, come nuovi test della pirogenicità in vitro. I farmaci parenterali devono essere testati per i pirogeni per escludere la possibilità di contaminazione batterica. L’originale test in vivo, introdotto nel 1940, misura la reazione alla febre con una sonda rettale inserita in conigli immobilizzati con un collare di ferro simile a una gogna. Alcuni animali possono soffrire di febbre, problemi respiratori o shock fatale. Il limite di rilevamento del test è al di sopra della soglia della febbre umana. È lungo e costoso e non adatto per nuove importanti aree terapeutiche come i prodotti cellulari.
Un secondo metodo, condotto ex vivo su campioni ematici di granchi reali (Limulus palyphemus) fu sviluppato negli anni settanta. Anche se la sua portata è limitata tra il 1988 e il 1998 il test sui Limulus ha fatto calare da 78.000 a 9.500 il numero annuale delle analisi su conigli effettuate in Gran Bretagna.
Una comprensione dei meccanismi della reazione umana alla febbre, unita ai progressi nelle tecniche di biologia cellulare, ha spinto allo sviluppo di nuovi test di pirogenicità in vitro utilizzando cellule ematiche umane. Basati sull’attivazione di monociti in risposta ai pirogeni, i nuovi test, ora pienamente avvalorati dall’ECVAM, evitano problemi di specificità delle specie e sono più sensibili, precisi, veloci e produttivi in relazione al costo. Rilevano una più ampia gamma di pirogeni che il test sui Limulus, e vengono adattati per l’uso con dispositivi medici e di inquinanti atmosferici ambientali; eppure poche persone credevano in precedenza che una funzione complessa come la febbre potesse essere replicata in provetta. La commissione europea stima che più di 200 laboratori in tutto il mondo stiano già mettendo in pratica i metodi in vitro, che sostituiranno ben 200.000 test sui conigli in un anno nella sola Europa.
Nella produzione e controllo di qualità dei vaccini e farmaci biologici, centinaia di migliaia di animali nel mondo sono stati risparmiati dall’introduzione di metodi cellulari. Considerare dei casi storici consente un’analisi più chiara delle cause e dei risultati, in una prospettiva a più lungo termine. Ad esempio, le prove di tossicità residua del vaccino contro la difterite e le prove di efficacia del vaccino contro la febbre gialla: il vecchio test di potenza per il vaccino contro la febbre gialla, che prevedeva l’inoculazione intracerebrale di siero immune e virus nei topi, venne introdotto nel 1950. Questo metodo che implica una dose letale non è stato mai completamente standardizzato e aveva scarsa riproducibilità, attribuita alla differente sensibilità al virus nei topi di diversa età, per le differenze nel processo di introduzione del virus e per il tipo di siero animale utilizzato. A fine anni settanta, un test di coltura cellulare basato sulla formazione di placche per rilevare anticorpi neutralizzanti è stato trovato più pratico, sensibile e riproducibile, sostituendo circa 1.500 topi ogni anno.
Tecniche fisico-chimiche, come i test colorimetrici e la cromatografia liquida ad alte prestazioni, sono stati introdotti come test di controllo della qualità per i farmaci biologici. La digitale era testata di routine per test di potenza su piccioni e cavie, con un metodo che richiede un’iniezione letale endovenosa. Alla fine del 1980, è stato sostituito da un esame chimico colorimetrico che misura direttamente la quantità di digitossina. Analogamente, il metodo delle convulsioni dei topi, in cui ogni lotto di insulina era testato su 600 topi per campione, è stato prima raffinato ed alla fine sostituito dalla cromatografia liquida ad alte prestazioni. Questa è stata introdotta come una tecnica più precisa e accettata come sostituzione dalla British Pharmacopoeia nel 199O. I test cromatografici hanno sostituito anche test biologici sugli animali per l’ormone della crescita, l’ossitocina e la lipressina.
Nella maggior parte degli esempi antecedenti alla fine del 1980, lo sviluppo dei test senza animali è stato spinto dalla insoddisfazione per i test esistenti sugli animali e la necessità di migliorare la precisione, range o riroducibilità. Le tecniche di sostituzione erano anche meno costose e davano risultati più rapidi. Nel caso di cosmetici e prodotti chimici, campagne di consumatori di alto profilo hanno dato la spinta e le direttive europee hanno ora imposto o facilitato la sostituzione di metodi sugli animali. Nell’ultimo decennio la nozione delle Tre R si è molto diffusa è la preoccupazione di risparmiare sofferenze agli animali è diventata una spinta sempre più forte verso altri sforzi per sostituirli.
Le simulazioni al computer nella ricerca medica: fisiologia feto-placentare e ortodonzia
I modelli animali di fisiologia umana feto-placentare sono di valore limitato, a causa della specificità di caratteristiche delle specie come (1) la struttura placentare, la permeabilità e il flusso sanguigno, (2) le risposte all’ipossia , (3) la vascolarizzazione amniotica, e (4) la composizione e le dinamiche del liquido amniotico. Ciò è particolarmente vero nel caso della sindrome di trasfusione tra gemelli, una grave condizione in cui i gemelli identici ricevono una vascolarizzazione diseguale nell’utero.
I limiti degli studi sugli animali hanno portato allo sviluppo di modelli al computer, basati originariamente sulle misurazioni cliniche dei tassi di crescita del feto, caratteristiche fenotipiche e discordanza di peso, ottenute mediante ultrasuoni. Colour Doppler e Power Doppler di flussi sanguigni e anastomosi vascolari nelle donne in gravidanza hanno fornito ulteriori dati, così anche gli studi su tessuti e organi umani in vitro ed ex vivo, come l’iniezione colorante placentare e la microscopia.
I primi modelli indicarono le cause di ipertensione indotta dalla gravidanza e preeclampsia. Nel 1995 avevano spiegato con successo il meccanismo alla base del notch diagnostico nel flusso arterioso uterino nelle donne a rischio di preeclampsia. Indivisuando la causa in un’anomalia dell’elasticità della parete arteriosa, le simulazioni al computer hanno annullato l’ipotesi precedente. La modellazione matematica ha anche dimostrato come uno squilibrio in alcune anastomosi nella placenta conduce alla sindrome di trasfusione fra gemelli, rivelando i legami tra trasfusione feto-fetale e squilibrio del liquido amniotico, il segno distintivo della sindrome. Questa scoperta ha portato a un test per predire la predisposizione delle donne e ha fornito un fondamento per classificare la gravità in modo che possano essere selezionati trattamenti ottimali.
I modelli continuano a migliorare e fornire importanti intuizioni sulla fisiologia della gravidanza umana. Essi ora incorporano funzionalità quali gli squilibri del sistema vascolare nel corion, la dinamica dei fluidi fetali, la crescita feto-placentare e le alterazioni circolatorie, l’insufficienza cardiaca fetale e aspetti del sistema renina-angiotensina. Ci si attende che questi sviluppi chiariscano il corso di malattie come la sindrome di trasfusione fra gemelli e contribuiscano a determinare l’efficacia delle terapie in uso e di quelle possibili in futuro.
La Finite Element Analysis ( FE ) è una tecnica presa in prestito dall’ingegneria. Si tratta di un approccio teorico in cui una struttura è modellata matematicamente e suddivisa in una maglia di elementi, delimitata da insiemi di nodi. Si utilizzano porocedure di calcolo per determinare effetti quali tensioni e stress causati da carichi applicati. Questi vengono poi visualizzati per identificare la loro entità e localizzazione precisa nella struttura. Dal 1973, quando è stata introdotta nella ricerca della biomeccanica dentale, l’analisi FE è stata molto utilizzata in studi di materiali dentali, chirurgia orale e maxillo-facciale, ortodonzia, restauri dentali e altro ancora. E ‘utilizzata per prevedere, quantitativamente e in tre dimensioni, le sollecitazioni e le tensioni imposte ai tessuti di denti e mascelle, per contribuire a valutare la sicurezza e l’efficacia di trattamenti e apparecchi dentali. (Vedi fig. 1).
Sulla base delle note proprietà strutturali dei denti, ossa e legamenti umani, e di materiali odontoiatrici come la ceramica e il titanio, l’analisi FE consente simulazioni dei risultati di trattamenti correttivi, in termini di proprietà di frattura, stress e tensioni a giunzioni, forza di adesione, influenze di carichi termici o meccanici e problemi di rottura.
Un esempio recente è un modello informatico basato sull’analisi FE di una vite in titanio sviluppato per l’impianto nell’osso mascellare come un appoggio per applicare pressione ortodontica. Una simulazione della vite e dell’osso circostante ha previsto la dislocazione provocata da una pressione correttiva applicata alla vite innestata. Il modello ha mostrato che le tensioni maggiori sarebbero state al livello del collo della vite e nell’osso al livello della prima filettatura. I risultati suggerivano che la vite avrebbe fornito un’adeguato ancoraggio, e hanno contribuito a indirizzare le decisioni cliniche
per il migliore utilizzo dell’impianto.
Alcuni esperimenti su animali condotti nella ricerca odontoiatrica sono invasivi, a lungo termine e causano rilevanti sofferenze. E comunque, le diversità morfologiche e biomeccaniche tra le specie fanno sì che gli studi sugli animali possano fornire solo un’ “indicazione approssimativa delle probabili conseguenze biomeccaniche nei pazienti “. Per essere ottimali i modelli FE devono essere avvalorati da e basati su dati umani.
Le simulazioni possono dare conoscenze importanti: per esempio, la modellazione FE di un dente umano e di un legamento sotto carico avvalorata utilizzando i dati di uno studio su volontari umani, ha rivelato che il legamento periodontale era il punto di maggiore sollecitazione. Ciò ha suggerito che la dislocazione iniziale del dente è mediata dal legamento piuttosto che dal rimodellamento cellulare nell’osso. L’ampio uso di simulazioni FE in odontoiatria ha sostituito alcuni esperimenti sugli animali, in particolare nella ricerca di nuovi apparecchi e materiali ortodontici, e nei casi dove ipotesi in competizione sarebbero state altrimenti esaminate utilizzando modelli animali.
La stimolazione magnetica transcranica nella ricerca cerebrale funzionale
La stimolazione magnetica transcranica (TMS) è una tecnica utilizzata nella ricerca cerebrale funzionale che, applicata a volontari umani, è ampiamente accettata come una sostituzione per alcuni esperimenti invasivi su primati non umani. Usando una bobina , la TMS applica alla testa un campo magnetico che inducendo attività neurale casuale interrompe in maniera transitoria e sicura una zona designata del cervello. Questo crea una ‘lesione virtuale’ e durante le decine di millisecondi (o più) di interruzione, i volontari svolgono attività cognitive, visive o altro per determinare l’effetto della ‘lesione’ sulla loro prestazione normale. Si può quindi dedurre l’ordinaria funzione di quella parte del cervello.
La stimolazione magnetica del sistema nervoso umano era originariamente concepita a metà degli anni Ottanta come una tecnica per la valutazione clinica della funzione nervosa centrale (specialmente la funzione motoria) in pazienti con sclerosi multipla e neuropatia demielinizzante. Il metodo convenzionale utilizzava una dolorosa stimolazione elettrica attraverso la pelle. La stimolazione magnetica, al contrario, era indolore e adatta sia per la valutazione clinica che per la ricerca. La tecnica è stata sviluppata in volontari umani confrontando la stimolazione magnetica e quella elettrica negli stessi individui. Sono stati inoltre condotti anche esperimenti su cani e primati benché non ci fosse la necessità di dimostrarne la sicurezza o per convalidare la tecnica, dal momento che questi studi erano già stati condotti con gli esseri umani .
Le applicazioni di ricerca della TMS si sono da allora estese al di là della funzione motoria per includere l’elaborazione centrale visuale e cognitiva, nonché lo sviluppo e la plasticità corticali. Creando una ‘lesione’ virtuale può dimostrare se un’area del cervello umano è effettivamente necessaria per una certa funzione, o semplicemente correlare l’attività neurale con un risultato, come accade con gli esami di risonanza magnetica funzionale o tomografia a emissione di positroni (PET).
La TMS unisce buone risoluzioni spaziali e temporali e molti vantaggi nelle ricerche sulle funzioni del cervello. Rispetto agli esperimenti in cui si causano lesioni cerebrali agli animali la TMS è superiore nel fornire una cronologia di attività in diverse aree cerebrali e per la sul soggetto stesso. Consente l’analisi dell’effetto di una lesione senza la complicazione di riorganizzazione funzionale, che si verifica dopo la lesione cerebrale nei convenzionali esperimenti su animali. La risoluzione spaziale della TMS non è paragonabile con gli esperimenti a livello cellulare che utilizano elettrodi sugli animali. Ma alcuni esperti ritengono che nella ricerca in psicologia cognitiva, per esempio, focalizzata a livello di sistema, gli studi funzionali sugli umani potrebbero fornire praticamente tutte le informazioni necessarie. Questo sostituirebbe molti esperimenti su primati non umani. Sicura e non invasiva , la TMS ha aperto le porte a una vasta gamma di studi del cervello umano senza le complicazioni dovute alle differenze di specie.
Procedure di sostituzione animale – ulteriori opportunità
Tre aree di ricerca medica – sepsi, malattie respiratorie e dolore – sono state selezionate per mostrare dove siano stati compiuti nella significativi progressi nella sostituzione degli esperimenti sugli animali. In ogni area, gli esperimenti possono comportare grandi sofferenze per gli animali; sono urgentemente necessarie delle innovazioni terapeutiche e la validità dei modelli animali è stata criticata.
La ricerca sulla sepsi
La sepsi è una complessa risposta dell’ospite alle infezioni gravi. Nonostante i notevoli progressi nel trattamento di terapia intensiva e lo sviluppo di antibiotici più efficaci, la mortalità di questa condizione rimane circa il 20-50 % . Si stima che nel 2004 circa 31000 pazienti siano stati ricoverati in terapia intensiva con la sepsi in Inghilterra, Galles e Irlanda del Nord e di questi 14.000 siano morti prima delle dimissioni: un tasso di mortalità del 45 % . Vi è una grande bisogno di sviluppare nuove terapie mirate a questa condizione.
Gli animali sono stati ampiamente utilizzati per studiare la fisiopatologia della sepsi , e come modelli per la malattia per testare nuove terapie mentre sono sviluppate. Sono state sviluppate due principali classi di modelli. Composti derivati da microbi, ad esempio il componente lipopolisaccaride batterico, possono essere utilizzati per simulare molte delle caratteristiche della sepsi, e sono fatali a dosi sufficientemente elevate. In alternativa le infezioni sperimentali con microbi vivi sono utilizzate per stabilire l’infezione sistemica e lo sviluppo della sepsi.
Entrambi questi modelli producono grandi cambiamenti fisiologici negli animali utilizzati e in Gran Bretagna possono essere classificati come ‘considerevolmente violenti’ dal Ministero dell’Interno, che regola gli esperimenti sugli animali Modelli animali hanno fornito una grande quantità di prove per stabilire i principali meccanismi fisiopatologici che operano durante la sepsi, e come un trampolino di lancio in sviluppo di nuove terapie. Tuttavia, si tratta di modelli imperfetti. Vi sono importanti differenze nelle risposte dei diversi animali, esseri umani inclusi, alla sepsi. Ad esempio, i roditori, la specie più utilizzata in tali lavori, sono circa 1000 volte più resistenti agli effetti tossici del lipopolisaccaride rispetto agli esseri umani. Inoltre, un numero elevato di trattamenti sperimentali di alto profilo ha funzionato bene in modelli animali ma è stato bocciati nelle sperimentazioni cliniche.
Alla luce di queste preoccupazioni etiche e scientifiche, si vede la necessità di sostituire e perfezionare modelli animali nello studio della sepsi, sia per ridurre la sofferenza degli animali che per migliorare la capacità predittiva dei modelli per lo sviluppo di nuove terapie per la sepsi umana. La natura complessa della sepsi rappresenta una vera sfida per sviluppare alternative alla sperimentazione animale che fornirà significative informazioni biologiche. Tuttavia, data la mancanza di successo dei modelli animali di sepsi nel predire risultati nell’essere umano vi è una reale necessità di sviluppare migliori modelli di predizione. Vi sono molti approcci che fanno ben sperare per il futuro.
Gli strumenti in vitro della biologia molecolare e cellulare forniranno ancora molte informazioni importanti in futuro. La capacità di manipolare tali sistemi in modo controllato permette di trarre solide deduzioni da trarre e testare nuove ipotesi. Nuovi metodi di coltura cellulare che usano supporti tridimensionali fanno ben sperare come modelli migliori per le funzioni dei tessuti (vedi fig. 2), e progressi della biologia delle cellule staminali potrebbero consentire la fabbricazione interamente in vitro di tessuti complessi. Allo stesso modo, il progresso compiuto nella modellazione al computer della sepsi può anche permettere modellizzazione di processi settici senza l’uso di animali.
Gli ultimi 50 anni hanno visto un notevole calo nel campo della sperimentazione clinica con soggetti umani. Benché benvenuto, l’aumento di controllo sugli studi umani ha portato a quanto pare ad un calo di tali approcci, sia su pazienti viventi che su materiale rimosso per successiva analisi in vitro. Entrambi questi approcci possono gettare luce considerevole sulla fisiopatologia della sepsi. Ad esempio, gli studi che esaminano il flusso sanguigno in volontari umani hanno indagato la venodilatazione alla base dei meccanismi che seguono la somministrazione di citochine, mettendo in luce il ruolo dell’ossido di azoto negli esseri umani viventi.
Un importante studio ha usato biopsie di bambini con sepsi meningococcica per studiare il ruolo della proteina C anticoagulante nella sepsi. La scoperta che l’attivazione endoteliale della proteina C era compromessa in questo contesto ha contribuito a sostenere lo sviluppo della proteina C attivata come terapia per la sepsi con alcuni benefici dimostrabili. Questo è un esempio concreto in cui dati derivati direttamente da studi sull’essere umano hanno aiutato nello sviluppo di una terapia utile. Allo stesso modo, biopsie muscolari prelevati da pazienti settici hanno dimostrato una grave disfunzione mitocondriale, suggerendo nuovi obiettivi per l’intervento terapeutico. Un maggiore uso di soggetti umani e materiale nella ricerca sulla sepsi potrebbe contribuire alla riduzione della sperimentazione animale, fornendo approfondimenti meccanicistici in questo grave problema medico.
La ricerca sulle malattie respiratorie
La maggior parte delle malattie che colpiscono i polmoni è di origine ambientale, prodotta da meccanismi infettivi, immunologici o tossicologici.
L’estensione delle vie respiratorie dell’epitelio alveolare, che ha la superficie di un campo da tennis, fornisce l’interfaccia tra l’ambiente esterno e il milieu di tessuto interno, che se affetto da disturbi porta a danni tissutali e malattie. L’epitelio svolge una funzione di barriera, fisicamente respingendo insulti ambientali, e funzionalmente attraverso il rilascio di diverse molecole bioattive e una gamma di attività metaboliche per inattivare o proteggere da agenti chimici.
Sono necessari nuovi agenti terapeutici per l’asma e broncopneumopatia cronica ostruttiva (BPCO), ma i modelli animali sono limitati a causa delle differenze strutturali e fisiologiche nelle vie respiratorie di topi e umani. Queste due malattie sono buoni esempi di disturbi associati all’ambiente che si rivelano attraverso un’accresciuta suscettibilità genetica e una serie di insulti ambientali es. fumo di tabacco, allergeni, sostanze chimiche e agenti infettivi. In entrambe le malattie, ci sono grandi differenze nella struttura e nella funzione dell’epitelio. L’epitelio rivela anche molti geni di suscettibilità candidati per queste malattie, identificati dalla clonazione posizionale. Per esempio, nell’ asma è stata trovata una forte associazione con polimorfismi di diversi geni che sono preferenzialmente espressi nell’epitelio.
Basandosi su interazioni gene-ambientali è stato possibile riprodurre alcune delle caratteristiche dell’asma e BPCO utilizzando l’ingegneria dei tessuti. Le cellule epiteliali rimosse dalle vie respiratorie di volontari con una broncoscopia a fibre ottiche possono essere coltivate a confluire in una coltura tissutale per 2-3 settimane. Queste forniscono una risorsa per investigare le caratteristiche basali e le risposte all’esposizione a stimoli pertinenti, es. inquinanti atmosferici , fumo di tabacco, virus. L’epitelio ricostituito in vitro da pazienti asmatici presenta un’aumento della permeabilità a causa della ridotta formazione di giunzioni occludenti e della suscettibilità alle sostanze inquinanti ossidanti. È anche più sensibile ai danni di virus del raffreddore comune (a causa della ridotta produzione di β e λ interferone).
Nel caso della BPCO le cellule epiteliali al basale in seguito all’esposizione di estratto di fumo di tabacco presentano anche marcatori di danno e riparazione che si verificano in vitro nelle cellule respiratorie dei pazienti, ma non in quelli da volontari normali. Anche il profilo di geni ossidanti protettivi espressa dalle cellule epiteliali di pazienti con BPCO al basale e quando esposte all’estratto di fumo di tabacco è correlato alla gravità della malattia in vivo. Come nell’asma, anche le cellule epiteliali coltivate di pazienti con BPCO mostrano una maggiore sensibilità agli effetti dannosi di virus del raffreddore comune che potrebbe spiegare perché tali pazienti siano più vulnerabili alle esacerbazioni indotte da virus. In entrambe le condizioni, i fenotipi correlati alla malattia persistono per più passaggi nella cultura tissutale, il che suggerisce che essi siano anomalie primarie piuttosto che secondarie.
Sulla base del sistema monostrato in vitro, è stato possibile produrre un epitelio delle vie respiratorie completamente differenziato coltivando le cellule su inserti, e dopo che esse hanno formato dei monostrati portando le cellule fino all’interfaccia aria/liquido. Con la rimozione dei fattori di crescita e aggiunta di acido retinoico, queste cellule si differenziano dopo 3-4 settimane in un epitelio pienamente stratificato con cellule ciliate funzionali che secernono muco calice. Se coltivate in presenza della citochina pro-asmatica IL-13, una percentuale elevata di cellule colonnari si trasforma in cellule caliciformi con evidenza di secrezione attiva di muco. Le cellule epiteliali differenziate coltivate da vie respiratorie asmatiche si comportano in modo diverso da quelli delle vie respiratorie normali: la formazione di giunzioni occludenti è carente, c’è una parallela riduzione della resistenza elettrica transepiteliale che indica un epitelio più ‘disperdente’ ( STH , osservazioni non pubblicate).
Poiché questi sistemi di coltura cellulare mantengono caratteristiche dei fenotipi della malattia, possono essere utilizzati per cercare nuovi bersagli molecolari che utilizzino piattaforme genomiche e proteomiche. Possono anche essere utilizzati come sistemi di test per nuove terapie come l’interferone-beta ricombinante umano nel ripristinare la resistenza al virus del raffreddore comune. Considerati nell’insieme, questi studi forniscono un solido fondamento per l’utilizzo di colture respiratorie epiteliali provenienti da pazienti ben fenotipizzati, per scoprire nuovi obiettivi terapeutici e testare nuove terapie per queste patologie in cui vi è un urgente bisogno di maggiore innovazione. Le simulazioni al computer sono state utilizzate anche per esplorare meccanismi di patologia asmatica e predire l’efficacia di trattamenti potenziali, contribuendo ulteriormente a sostituire alcuni esperimenti sugli animali.
La ricerca sul dolore
Il dolore può solo essere descritto e confermato nell’essere umano in termini di un’ esperienza integrata che è sensoriale, affettiva e motivazionale. Sebbene la maggior parte del dolore è generato dalla attivazione di terminazioni nervose specializzate (nocicettori), il dolore può anche derivare da danni al sistema nervoso o di stress psicologico.
Esperimenti di imaging funzionale del cervello su volontari hanno dimostrato una matrice di centri corticali superiori implicati nell’insieme dell’integrazione cognitiva che si traduce in dolore. Alcuni di questi centri superiori, come ad esempio la corteccia cingolata, sono scarsamente sviluppati in molti non-primati.
Esperimenti di imaging funzionale del cervello su volontari hanno dimostrato una matrice di centri corticali superiori implicati nell’insieme dell’integrazione cognitiva che si traduce in dolore. Alcuni di questi centri superiori, come ad esempio la corteccia cingolata, sono scarsamente sviluppati in molti non-primati.
Il presupposto che le scoperte possano essere facilmente trasferite da una specie all’altra è messa in discussione da un lungo elenco di farmaci che sono efficaci nel ridurre le risposte nocicettive negli animali, ma non sono riusciti come analgesici negli studi clinici. La sfida ora è quella di determinare come possiamo sviluppare analgesici nuovi e sicuri più efficientemente.
I modelli animali ci hanno fornito informazioni chiave sulle connessioni anatomiche dettagliate dei percorsi nocicettivi e dei potenziali meccanismi fisiologici della percezione del dolore. Tuttavia, l’attenzione degli studi sugli animali e stata posta sulla nocicezione (sensibilità dei nocicettori agli stimoli dolorosi) in di strutture alla fine del tronco cerebrale. I modelli animali di dolore sono stati molto riesaminati di recente. In generale, viene osservato il comportamento degli animali o sono registrate le risposte nel sistema nervoso, mentre uno stimolo nocivo viene applicato prima e dopo qualche tipo di intervento fisiologico. Il problema principale con l’interpretazione di modelli animali è che le osservazioni comportamentali sono limitate a risposte motorie e queste non possono essere facilmente ricondotte ad un cambiamento della sensazione del dolore. I modelli di dolore degli animali possono pertanto produrre solo alcuni possibili indizi per meccanismi potenziali del dolore negli esseri umani.
Il dolore viene percepito come il risultato dell’attività integrata di strutture cerebrali ben definite e vi sono due sistemi principali: centrale e periferico. Studi di imaging funzionale cerebrale su umani hanno fornito informazioni essenziali su come queste strutture contribuiscano alla percezione del dolore umano normale e anormale in volontari e pazienti. (Vedi fig. 3). Per esempio, gli studi PET che misurano indirettamente l’attività sinaptica nel cervello sono stati utilizzati per stabilire che i sistemi del dolore mediale e laterale sono principalmente coinvolti rispettivamente con l’elaborazione di dolore emotivo (ad esempio sgradevolezza) e l’elaborazione sensoriale-discriminante (ad esempio la localizzazione del dolore). Utilizzando una diversa tecnica PET che rappresenta il legame dei recettori sui neuroni, è stato possibile misurare variazioni nell’attività di antidolorifici naturali chiamati endorfine, in diversi tipi di dolore cronico. Fra gli approcci complementari l’analisi dei tessuti post mortem, che fornisce un”istantanea’ delle differenze chimiche nei neuroni periferici e centrali (es. midollo spinale), in relazione ad anomalie sensoriali nei pazienti con dolore dovuto a un danno nervoso.
La sfida è di usare questi diversi tipi di informazioni per sviluppare nuove terapie per il dolore in modo più efficace. Suggeriamo alcuni approcci per raggiungere questo obiettivo. In primo luogo, occorre passare dalla classificazione del dolore in base all’anatomia, alla malattia e al tempo ad una definizione più fisiologica di sindrome da dolore clinico, facendo uso di metodi fisiologici come tecniche di imaging cerebrale funzionale. Ciò può essere ottenuto mediante l’accurata misurazione fisiologica e psicologica in pazienti con diversi tipi di sindrome da dolore. Per esempio, abbiamo (AJ) recentemente identificato una incapacità di modificare la reazione al dolore in pazienti con un tipo di dolore cronico diffuso chiamato fibromialgia.
Per raggiungere un approccio più fisiologico di classificazione del dolore sarà necessario identificare i normali meccanismi fisiologici e fisiopatologici della percezione del dolore. Per esempio, studi PET hanno mostrato una riduzione selettiva dei recettori per gli oppiacei naturali nel cervello di pazienti con forti dolori causati da ictus. Tali studi richiedono investimenti consistenti e una maggiore collaborazione tra l’industria farmaceutica e del mondo accademico. In seguito all’individuazione dei meccanismi negli esseri umani, lo sviluppo di farmaci mirati dovrebbe essere strettamente basato sull’adattamento di questi meccanismi. Dopo aver individuato e misurato i meccanismi fisiopatologici, i prototipi delle sperimentazioni saranno molto più produttivi in relazione al costo. Sarebbe ideale che nessun farmaco venga sviluppato senza aver dimostrato prima dei test clinici che esso raggiungerà l’organo bersaglio nell’essere umano. In molti casi ciò si può ottenere utilizzando l’imaging molecolare, ad esempio la PET.
Riassumendo, esistono le tecniche per cominciare a riclassificare il dolore umano fisiologicamente e per identificare meccanismi fisiopatologici candidati nei volontari. Risalendo da questi meccanismi allo sviluppo di farmaci, si possono sostituire alcuni esperimenti sugli animali. Questo non è al di là delle capacità attuali di imaging molecolare, ma richiederà un profondo cambiamento nel modo di pensare al dolore.
Cosa c’è da fare adesso?
Storicamente l’impulso di sostituire le procedure sugli animali ha coinvolto aspetti umani e scientifici, ed è ancora così. Il riconoscimento della capacità degli animali di provare dolore e angoscia fornisce un impulso crescente per il progresso, più evidente nei test normativi in cui lo sviluppo di metodi senza animali è stato abbracciato da tossicologi, legislatori e regolatori. Singoli scienziati preoccupati per l’uso degli animali hanno avuto un impatto significativo in particolari settori, come la sperimentazione di vaccini.
L’insoddisfazione per la qualità dei dati ricavati dagli animali resta una forte motivazione per il cambiamento, e la ricerca di alternative superiori sta attirando sempre fondi governativi. La Commissione europea sta supportando un programma di ricerca per sostituire tossicologia basata sugli animali facendosi promotore di un contributo alla qualità della scienza e la sicurezza dei consumatori, prevenendo allo stesso tempo la sofferenza degli animali.
Nel mondo accademico, dove l’accento va più sulla la ricerca medica fondamentale, il cambiamento è stato più lento. Ci sono diversi motivi: (1) le domande di ricerca aperte sono considerate più difficili da perseguire senza esperimenti su animali, (2) vi sono poche vie per esercitare la pressione dei consumatori e (3) la ricerca accademica è meno definita da iniziative legislative e normative. Tuttavia, la recente riconsiderazione sistematica di come la ricerca sugli animali si traduca o meno in un beneficio clinico può ben indicare un cambiamento.
Diverse fra tali critiche hanno dimostrato che gli studi sugli animali sono stati scarsamente predittivi di esiti umani. In particolare, sono state trovate discordanze fra dati umani e animali per (1) corticosteroidi nelle lesioni alla testa, (2) anti-fibrinolitici nel sanguinamento, (3) tirilazad per l’ictus e (4) farmaci neuroprotettivi nell’ictus.
Una revisione sistematica di studi su animali molto citati pubblicati in sette pubblicazioni scientifiche leader, ha rilevato che solo il 37% di questi hanno portato a sperimentazione umana di successo. Una delle domande cruciali in questi e altri articoli è se i modelli animali imitino le malattie umane ad un grado sufficiente.
Il cambiamento è in arrivo. Sviluppi legislativi, come il nuovo quadro normativo di gestione delle sostanze chimiche (regolamento REACH, ndt), e la revisione della normativa europea in materia di spementazione animale, potrebbero accellerare il passo. L’impressione che la ricerca per sostituire gli animali sia un settore di nicchia è stata superata, e possibilmente il concetto di sostituzione sarà supportata su pubblicazioni scientifiche tradizionali. Negli Stati Uniti il comitato di coordinamento interistituzionale sulla convalida di metodi alternativi (ICCVAM) ha appena elaborato un piano quinquennale per lo sviluppo e convalida di metodi alternativi alla sperimentazione animale; il Giappone ha istituito un centro di metodi alternativi nel 2005. Grandi finanziatori come la Wellcome Trust stanno timidamente muovendo i loro primi passi per sostenere questa ricerca. Organizzazioni influenti come la Royal Society e il Nuffield Council on Bioethics nelle loro pubblicazioni riconoscono sempre più i limiti dei dati animali nella ricerca medica.
Sostituire gli esperimenti sugli animali è una sfida culturale che richiede flessibilità e apertura a nuove idee, e una sfida scientifica che necessita di un fresco approccio interdisciplinare. La ricerca di cui si ha bisogno ha anche il potenziale per dare una spinta alla scienza, migliorare il progresso medico e proteggere meglio la sicurezza dei pazienti e dei consumatori.
Ringraziamenti
Siamo molto grati per l’assistenza data da Nevil Chimon e
Alison Watson, e di Georges Limbert e John Middleton
per il permesso di riprodurre la figura 1.
Figura 1
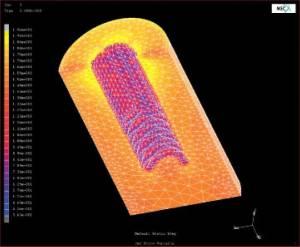
La simulazione basata sull’analisi tridimensionale a elementi finiti dell’adattamento di un osso attorno a un impianto a vite. La scala colorata rappresenta le variazioni previste nella densità ossea in risposta all’impianto. La dnsità è direttamente correlata alla resistenza ossea e, dopo l’inserimento dell’impianto, si sviluppa in un processo di danno/riparazione che continua fino al raggiungimento di un equilibrio meccanobiologico. Le simulazioni al computer possono dare una comprensione approfondita di meccanismi di feedback complessi e dei vari parametri coinvolti, predicendo il tasso di osteointegrazione e quindi la durata dell’impianto, nei successivi 80 giorni. Con il permesso di Georges Limbert e John Middleton.
Figura 2.
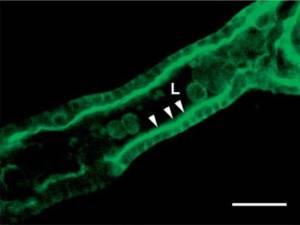
Tubulo renale coltivato in vitro.
Cellule epiteliali primarie del tubulo renale umano sono state coltivate in una matrice di collagene tridimensionale in presenza del fattore di crescita degli epatociti per incoraggiare la tubulogenesi. Le cellule sono state fissate e colorate per la proteina actina-associata ezrin (verde ) che è concentrata nel bordo a spazzola (frecce) rivolto verso un lumen tubolare centrale (L). Tali colture cellulari tridimensionali possono essere
utilizzate per studiare i danni tissutali nella sepsi . Scala bar 100 µm.
Figura 3.
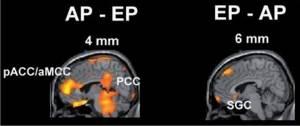
Le sezioni di aree cerebrali di 4 e 6 mm che dimostrano una maggiore attivazione nelle aree del sistema di dolore mediale in pazienti (AP) con una condizione di dolore artritico (AP-EP), rispetto alla condizione (EP-AP) di dolore sperimentale (EP).
pAcc, corteccia cingolata anteriore perigenuale; aMcc, corteccia cingolata anteriore; PCC, corteccia cingolata posteriore; SGC, corteccia cingolata subgenuale.






