Tanto tempo fa, quando l’illuminazione casalinga era dominata da tremolanti fiammelle che consumavano un timido stoppino immerso in un cilindro di cera solida, forse era più facile viaggiare all’interno di quel mondo fantastico generato da chi osava curiosare in quegli strani “meccanismi” della natura, scoprendo al termine di un lungo percorso anche i più piccoli segreti chimici che una misera candela nascondeva dietro la sua scontata semplicità!
Tanto tempo fa, quando l’illuminazione casalinga era dominata da tremolanti fiammelle che consumavano un timido stoppino immerso in un cilindro di cera solida, forse era più facile viaggiare all’interno di quel mondo fantastico generato da chi osava curiosare in quegli strani “meccanismi” della natura, scoprendo al termine di un lungo percorso anche i più piccoli segreti chimici che una misera candela nascondeva dietro la sua scontata semplicità!
Dalla cera delle api, all’estratto di cannella, dal grasso dei pesci candela al sebo dei mammiferi, numerosi e diversi sono stati i materiali utilizzati per la manifattura delle candele, eppure per tutti quanti è possibile riassumere la reazione di combustione in una singola formula esaustiva che li comprende indiscriminatamente:
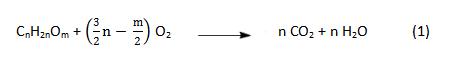
Un’equazione come questa fornisce in modo diretto e semplificato l’informazione di come inizia e come termina una qualsiasi combustione che si verifica accendendo (anche) una candela, tuttavia possiamo facilmente immaginare che le cose siano un tantino più complesse, e si potranno (ri)scoprire proseguendo nella lettura, ma solo se siete altrettanto curiosi di quanto lo furono i fortunati allievi di Faraday durante le sue lezioni …
Michael Faraday durante un esperimento. Credit: Ithaca College
Non c’è infatti legge che governi le varie parti dell’universo che non si manifesti in questo fenomeno. E non c’è mezzo migIiore, né piu efficace, per entrare nel dominio delle scienze naturali che studiare il fenomeno fisico di una candela che arde.
Così esordiva il chimico e fisico inglese Michael Faraday nella prima delle sue celebri lezioni dedicate alla storia chimica di una candela che egli fece presso il Royal Institution tra il 1827 e il 1860, e di cui se volete a questo link sono disponibili i primi due capitoli (integrale in inglese grazie al progetto Gutenberg). Da parte mia tenterò di sintetizzare la storia chimica di una candela in chiave moderna, seguendo le tracce di Faraday, dalle materie prime al festoso utilizzo di queste magiche combustioni che continuano ad evocare la nostalgia di tempi lontani.
Le candele più antiche di cui si ha notizia risalgono al III secolo prima di Cristo, ovviamente made in China, durante il dominio della dinastia Qin, e venivano preparate con grasso di balena. Fino alla metà del XVIII secolo, le candele di qualità erano fatte quasi esclusivamente con cera d’api, distinguibili per la fiamma superba e attrattiva, che nel contempo libera una piacevole fragranza che diffonde il suo caratteristico aroma nell’ambiente. Queste tuttavia erano considerate un bene di lusso riservato principalmente ai luoghi di culto, ai monasteri e alle case dei nobili. Il popolo poteva contare solo su candele scadenti a base di grassi animali come il bue o il montone, e che bruciando liberavano un fumo nerastro e fuligginoso che permeava la casa di un odore disgustoso e penetrante.
Justus Liebig fu il primo a esaminare la natura chimica della cera d’api, e la classe di composti chimici chiamati genericamente cere in seguito venne descritta come miscela di esteri derivati da acidi carbossilici e alcoli, entrambi con lunghe catene di atomi di carbonio. Tuttavia si trattava di una definizione errata, poiché normalmente sono presenti anche una certa varietà di acidi carbossilici e altri idrocarburi a catena lunga fino a 30-32 atomi di carbonio, oltre a un 5% della sua composizione che ancora non è stata del tutto identificata.
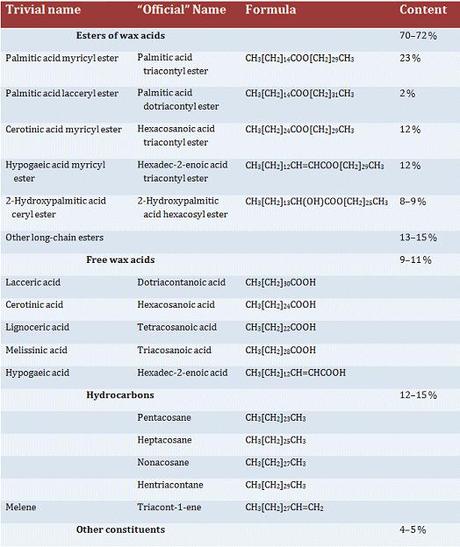
Tabella 1 - Composizione chimica della cera d'api
Oggi, in un contesto industriale, le cere non sarebbero state definite tramite la loro formulazione chimica, bensì attraverso le singole proprietà fisiche, come la trasparenza, l’opacità, il punto di fusione, di rammollimento e la viscosità della fase liquida, tanto per fare qualche esempio.
La prima cera semi-sintetica fu realizzata da Michel Eugène Chevreul nei primi anni del XIX secolo, quando si interessò della saponificazione alcalina del lardo. Una successiva acidificazione del materiale solido così ottenuto produceva ciò che egli definì stearina, un trigliceride, o meglio un estere glicerico dell’acido stearico. La stearina prodotta da Chevreul era dura a temperatura ambiente e mostrava quel biancore opaco così apprezzato dai cerai intenditori. L’intervallo di temperatura che caratterizza la sua fusione, da 52 a 60 °C, considerato anche il suo vicino punto di rammollimento, risultava ottimale affinché una candela di stearina mantenesse la sua forma anche in una stanza calda. Oggi sappiamo che la stearina non è altro che una miscela di acido palmitico e acido stearico, due fra i più comuni acidi grassi saturi rispettivamente a 16 e 18 atomi di carbonio, e che secondo IUPAC andrebbero chiamati esa- e ottadecanoico. L’acido margarico o eptadecanoico, è invece molto più raro in queste miscele.
Dalla metà del XIX secolo in poi, per la fabbricazione delle candele si utilizzò in prevalenza la paraffina, una miscela di idrocarburi saturi che ora si ottiene quasi esclusivamente dal petrolio. Il punto di fusione della paraffina varia con la lunghezza media delle catene dei suoi componenti. Le paraffine pure sono incolori, trasparenti e sono caratterizzate da un ampio spettro di punti di rammollimento. Le candele di paraffina oggi occupano oltre il 95% del mercato, mentre la stearina incide per il 3% e la cera d’api solo per il 2%.
Lo stoppino è l’anima di una candela. Il suo compito è quello di riversare verso la fiamma una quantità sufficiente di cera fusa affinché si possa stabilire un equilibrio stabile tra la cera liquefatta che si accumula e quella che alimenta la combustione. Se l’apporto verso la fiamma è scarso, la cera liquida in eccesso si raccoglie alla base dello stoppino e la fiamma si estingue, nel caso contrario, la cera non è più in grado di bruciare completamente, pertanto la candela comincia a fumare.
Dobbiamo a Jules de Cambacérès l’invenzione dello stoppino di cotone intrecciato, il quale dal 1828 fino a oggi ha rappresentato un importante progresso nella storia della candela. Il potere drenante di tale stoppino può essere regolato per soddisfare al meglio il diametro e il tipo di cera della candela che animerà, variando semplicemente il numero dei filamenti. Così, per una candela di 10 mm (paraffina 90%, stearina 10%), è necessario uno stoppino con 24 filamenti di cotone, mentre per una candela il cui diametro è di 15 mm, ne servono 33.
Le qualità di combustione di una candela possono essere migliorate disponendo di uno stoppino elicoidale intrecciato che si pieghi su un lato al raggiungimento di una certa lunghezza, in modo che la punta dello stoppino si proietti nella parte più calda della fiamma. Così mentre brucia, si predispone una sorta di regolazione automatica della lunghezza dello stoppino, che garantisce ancor di più l’equilibrio citato poc’anzi, rendendo quindi obsoleto il detestabile “taglio manuale” degli stoppini che i nobili pretendevano dai loro servitori. Un ulteriore miglioramento venne raggiunto impregnando lo stoppino con una soluzione acquosa di sali di ammonio, acido borico e fosfati. I sali di ammonio impediscono allo stoppino di ardere troppo rapidamente, mentre l’acido borico e i fosfati generano una perlina fusa alla sommità dello stoppino, la quale a sua volta previene che pezzi di cenere roventi si tuffino nella piscina di cera sottostante, evitando contemporaneamente l’inutile emissione affumicante una volta spenta la candela.
La candela si produce in diversi modi, che spaziano dalla creazione di singoli pezzi, come nelle migliori tradizioni consacrate nel tempo, alla manifattura high-tech controllata dal computer. Tuttavia il principio è molto semplice come potete immaginare: uno stoppino centrato dovrà essere ricoperto da un combustibile solidificato, per mezzo di una forma nella quale la cera viene colata, ma anche per immersioni ripetute dello stoppino e forse anche tramite l’applicazione della cera pressata attorno ad esso.
La cera può contenere uno o più additivi, ad esempio per renderla più opaca, o per colorarla secondo particolari esigenze con un apposito colorante, solubile o finemente diviso. L’opacità può anche essere indotta introducendo bollicine di aria, un processo che può essere utilizzato anche per preparare le leggerissime candele galleggianti. Infine è anche possibile rivestirle con cera colorata, e rifinirle con disegni, incisioni e altri accorgimenti artistici per rendere il prodotto ancor più raffinato e gradevole.
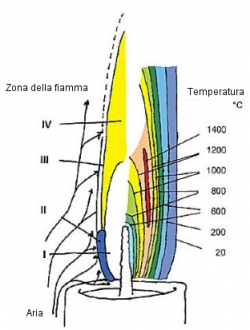
Fig. 1 La fiamma di una candela
Passiamo ora a considerare il flusso di calore correlato ad una candela che brucia nella sua quiete (Fig. 1). Una parte del calore di combustione viene utilizzato per fondere la cera, che in seguito sarà risucchiata per capillarità nello stoppino e che infine evaporerà dalla sua superficie. Nel corso del suo viaggio successivo, la cera gassosa brucia, per fornire acqua e anidride carbonica. Come nel caso di un camino, la formazione di gas caldi e leggeri induce una circolazione dell’aria fresca dell’ambiente circostante che parte dalla base della fiamma per lambirne poi entrambi i lati.
Questa corrente fredda agisce anche sulla superficie della candela impedendo lo scioglimento del bordo superiore in modo da “costruire” un argine solido intorno ad una depressione concava ricolma di cera fusa che brama di colare giù. In pratica si stabilisce una condizione relativamente statica o stato stazionario, un equilibrio dinamico tra il processo di fusione e la cera in fase di combustione, mentre la fiamma assume una forma allungata proprio a causa dell’ascensione di quella stessa corrente di aria che è allo stesso tempo l’ultimo e il primo anello del ciclo.
Un’indagine sperimentale approfondita della fiamma della candela in realtà non è del tutto possibile. I motivi di ciò sono facilmente intuibili: in primo luogo, la fiamma non sarebbe stabile rinchiusa all’interno di un’apparecchiatura per l’analisi, inoltre, nulla del processo di combustione è davvero soggetto ad alterazione. Di sicuro è possibile variare alcuni aspetti come la composizione della cera, le dimensioni della candela, il materiale e la geometria dello stoppino, anche se non possiamo farlo durante la combustione. Introdurre una sonda nella fiamma causerebbe una perturbazione alterandone la distribuzione delle temperature e distorcendo di fatto qualsiasi misurazione.
È tuttavia possibile, con l’approccio dei moderni laser, misurare temperature istantanee senza alcun tipo di contatto, come anche le concentrazioni di alcuni componenti (ad esempio, N2, O2, CO, H2O) e perfino in condizioni di fiamma instabile, ma ciò comporta maggiore impegno e maggiori costi dal punto di vista delle apparecchiature necessarie. Superando tali ostacoli sperimentali, siamo riusciti ad apprendere molti piccoli dettagli per quanto riguarda i processi che realmente si verificano all’interno della fiamma di una candela. In aggiunta sono stati condotti numerosi studi approfonditi su altri tipi di fiamme tecnicamente più importanti, come ad esempio, quelli associati alla produzione di calore o fumo, o che trattano di combustioni all’interno di vari tipi di motori, fino ai motori a reazione e missilistici. I risultati corrispondenti rendono possibile con una certa affidabilità l’estrapolazione di un modello applicabile al caso di una candela, fornendoci almeno un’immagine indiretta della chimica che agisce all’interno di questo tipo di fiamma.
Esiste una serie di prodotti intermedi altamente energetici presenti in fase gassosa e ad una temperatura di 1400 °C all’interno della fiamma di una candela, che appaiono piuttosto esotici alla maggior parte di noi, data la loro assenza nei libri di testo introduttivi, ed è possibile distinguere quattro zone della fiamma che possono essere descritte come segue:
- Una prima zona oscura all’interno della fiamma (zona I), dove le molecole di paraffina sono principalmente coinvolte nella scissione termica.
- La zona II, una regione luminosa con tonalità blu-verde che corre lungo i bordi laterali e inferiori della fiamma.
- L’unica parte debolmente luminosa della zona di reazione, la zona III si trova lungo i bordi superiori esterni.
- L’area gialla luminosa e pallida che si estende dal centro fino alla punta visibile della fiamma è la zona IV.
A questo punto possiamo seguire una singola molecola di cera e assistere a quello che le accade durante questa parte del suo percorso attraverso le quattro zone. La nostra molecola in prima istanza evapora nella zona I, direttamente dalla superficie dello stoppino.

Fig. 2. Esperimento effettuato da Michael Faraday (1861).
Nonostante il piccolo spazio che separa lo stoppino dalle zone calde della reazione, ovvero le zone II e III, la temperatura dello stoppino stesso arriva “solo” a 600 °C, dal momento che il processo di evaporazione della cera è fortemente endotermico, ovvero consuma calore. L’evaporazione della cera è facilmente evidenziabile tenendo un’estremità di un tubicino di vetro nella parte inferiore della zona I. All’esterno della fiamma possiamo vedere la cera incombusta che si deposita sul vetro, e che eventualmente si può accendere.
La temperatura nella zona oscura aumenta spostandosi verso l’alto o verso l’esterno, poiché la distanza dalle zone calde di reazione in tal modo diminuisce. In queste zone l’ossigeno non è più disponibile, quindi l’aumento della temperatura porta solo ad una maggiore decomposizione termica. Per semplicità, ipotizziamo che il materiale combustibile della nostra candela sia paraffina, con una formula molecolare generica del tipo CnH2n+2.
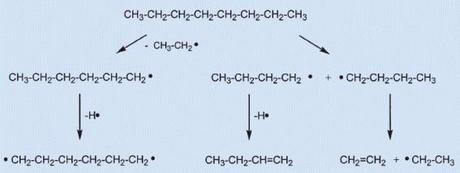
Fig- 3. Termolisi degli idrocarburi a catena lunga
Nella prima fase della reazione i legami C-C si rompono per produrre coppie di radicali altamente reattivi: la successiva eliminazione di atomi di idrogeno produce olefine, l’eliminazione di un radicale etilico (CH3CH2-) conduce a radicali più corti, e infine le coppie di radicali possono diventare ciclici, così da eliminare ulteriore idrogeno, e così via…
In generale si verifica una sorta di “concerto” di reazioni multiple e confuse, che produce una serie di idrocarburi insaturi più piccoli, alifatici, aliciclici e aromatici che siano. Gli atomi di idrogeno che si liberano nel frattempo, da una parte generano nuovi radicali, mentre dall’altra, a causa della loro esile massa, si diffondono rapidamente nelle zone di reazione. In ogni caso nelle parti più calde della zona I, ogni molecola di cera viene scissa termicamente, pertanto nella fiamma di una candela nessuna molecola di cera arriva intatta a toccarne una di ossigeno.
Addentandoci nel cuore della fiamma di una candela, la zona di reazione, scopriamo un processo che si chiama decomposizione pirolitica o pirolisi, i cui prodotti arrivando dall’interno incontrano l’ossigeno che si diffonde dall’esterno. Le reazioni di ossidazione altamente esotermiche che seguono, sono limitate solo dall’approvvigionamento di opportune quantità di reagenti.
Se la fiamma di una candela non produce fumo, allora è completamente confinata nell’equilibrio delle sue zone di reazione. Allora la domanda sorge spontanea: perché la parte inferiore della zona di reazione II, sembra bruciare con una luce blu-verde, mentre la zona III apparentemente non emette alcuna luce, anche se in tutte le zone di reazione si verificano gli stessi processi? La risposta è piuttosto sorprendente: si tratta di un’illusione ottica! L’emissione brillante giallognola proveniente dalla zona IV, sovrasta ed eclissa completamente la debole luce blu delle zone di reazione limitrofe, con il risultato che i nostri occhi distinguono solo la luce blu che arriva dalla zona II, quella più lontana.
Due insolite molecole tradiscono la loro presenza proprio grazie a questa luce bluastra, un colore a noi familiare come quello della fiamma del gas naturale (metano) di una cucina a gas o di un becco Bunsen. In questi dispositivi, il gas naturale viene miscelato con aria prima della fiamma, ed è la miscela risultante ciò che brucia (fiamma premiscelata). Al contrario la fiamma di una candela è rigorosamente una “fiamma diffusa“, dove l’aria fornisce l’ossigeno necessario diffondendosi dall’ambiente. La banda caratteristica dello spettro prodotta da questo tipo di fiamma deriva da due fonti molecolari. La prima produce un’emissione viola a 432 nm, ed è dovuta a molecole elettronicamente eccitate (CH*), che si generano nelle zone di reazione in questo modo:
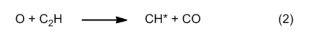 Nello stesso ambito, la luce blu verdastra proviene da un’altra molecola elettronicamente eccitata (in simboli, C2), con le sue caratteristiche “bande di Swan“, che producono emissioni nel visibile a 436, 475 e 520 nm. Il C2 eccitato si forma principalmente attraverso reazioni tra atomi di ossigeno e radicali di idrocarburi più poveri di idrogeno. Un’altra emissione può essere infine rilevata a 315 nm nella regione del vicino ultravioletto, ed è causata da radicali ossidrile eccitati (OH*) provenienti dal lato ricco di ossigeno della zona di reazione, secondo la seguente reazione:
Nello stesso ambito, la luce blu verdastra proviene da un’altra molecola elettronicamente eccitata (in simboli, C2), con le sue caratteristiche “bande di Swan“, che producono emissioni nel visibile a 436, 475 e 520 nm. Il C2 eccitato si forma principalmente attraverso reazioni tra atomi di ossigeno e radicali di idrocarburi più poveri di idrogeno. Un’altra emissione può essere infine rilevata a 315 nm nella regione del vicino ultravioletto, ed è causata da radicali ossidrile eccitati (OH*) provenienti dal lato ricco di ossigeno della zona di reazione, secondo la seguente reazione:
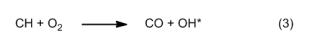
Tutte le specie eccitate rilasciano spontaneamente il loro eccesso di energia sotto forma di luce dando luogo al più semplice dei fenomeni chiamati chemiluminescenza.
Anche le reazioni di ossidazione che si verificano nelle zone di reazione II e III, seguono un percorso sorprendente. Qui però il principale agente ossidante non è l’ossigeno, bensì l’ossidrile radicalico OH. Come nella reazione Knallgas dell’ossidrogeno, i radicali OH si formano a partire da singoli atomi di idrogeno (4), a loro volta prodotti fra l’altro con reazioni di sostituzione (5).
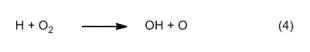
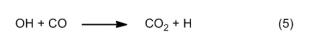
Qui è possibile riconoscere una sorta di reazione a catena, che diventa anche più efficace grazie agli atomi di ossigeno che si formano nel primo passaggio (4). Questa catena è il vero motore che guida una combustione idrocarburica. La concentrazione dei radicali OH è massima al bordo esterno delle zone di reazione, motivo per cui vi si trova anche la temperatura più alta temperatura, di circa 1400 °C.
Finalmente arriviamo alla parte più affascinante della fiamma di una candela: la zona IV, che è la zona responsabile di quella calda e familiare atmosfera dovuta al tremolante bagliore giallognolo caratteristico di una candela. Da dove proviene di preciso la luce generata?

Fig. 4 - Esperimento di Michael Faraday (1861).
Questo è un altro caso in cui Faraday riuscì a ideare un esperimento tanto semplice quanto utile: se illuminiamo la nostra candela che brucia con una potente sorgente luminosa ed esaminiamo l’ombra risultante (Fig. 4), l’unica cosa che si distingue chiaramente è l’ombra associata con la zona IV.
È curioso che in quest’ombra ciò che vediamo come la parte più oscura deriva da quella porzione della fiamma che in realtà è la più luminosa, come osservò Faraday quando svolse il suo esperimento per la prima volta. Un’ombra scura potrebbe verificarsi solo se fossero presenti particelle relativamente grandi, di quelle che assorbono tutte le lunghezze d’onda della luce visibile. Faraday fu capace di stabilire la natura generale di queste particelle nella zona IV della fiamma, deviando il percorso di alcune di esse verso l’esterno attraverso un tubo di efflusso (Fig. 2), rivelandosi infine come semplice fuliggine.
Quindi, come può emergere la luce dalla zona IV attraversando la fuliggine? Nella parte più calda e priva di ossigeno della zona I, si formano molecole ricche di carbonio che non possono essere descritte con semplici formule di struttura. Inizialmente queste prime particelle di fuliggine hanno a grandi linee una formula del tipo (C3H)n, ciascuna composta da diverse migliaia di atomi di carbonio. La formula empirica suggerisce elementi aventi una struttura ciclica e molto insatura (ricca cioè di doppi e tripli legami), eventualmente anche aromatica, cioè con un anello di atomi di carbonio a doppi legami delocalizzati.
Il particolato carbonioso si accresce tramite agglomerazione, disidratazione e coagulazione di almeno qualche milione di atomi di carbonio. La fuliggine risultante si forma nella zona IV a temperature superiori a 1200 °C, quando è incandescente. In altre parole, la luce gialla delle candele non è il risultato diretto di una reazione chimica, bensì proviene dalle particelle solide di fuliggine che veicolano la trasformazione termica della loro energia in luce, dove gli elementi gialli e rossi dello spettro sono più intensi del blu, lasciandoci percepire una luce gialla quasi esclusiva.
Il particolato carbonioso prodotto termicamente dalla zona IV povera di ossigeno, viene ossidato a CO o CO2 nelle zone di reazione superiori. La combustione di tali particelle è completa tuttavia, solo se la temperatura raggiunge almeno i 1000 °C. Se raffreddiamo la parte superiore della fiamma di una candela, come quando ci soffiamo sopra o sventolando un foglio, la fuliggine non è più in grado di reagire completamente e la candela comincia a fumare.
I principali prodotti della combustione di una candela come abbiamo visto sono anidride carbonica e acqua, tuttavia si formano anche altri composti, sebbene in quantità modeste. Le strutture chimiche e la quantità di questi sottoprodotti oggi sono di notevole interesse, dal momento che abbiamo imparato quanto può essere importante assicurarci che le persone in una stanza non siano esposte a inutili rischi per la salute, qualora utilizzino le candele per qualsiasi uso gli compete. In tabella si può notare una comparazione fra alcuni di questi prodotti minori, che si sviluppano in diverse situazioni.
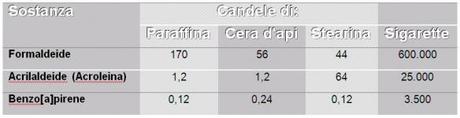
Tabella 2 - Concentrazioni di inquinanti nell'ambiente dopo la combustione di vari tipi di candele. (ng/m³ di vari composti per 600 g di massa di candele in rapporto a una sigaretta, arsi in una stanza da 50 m³ senza ricambio di aria)
Ma quale forma assume questo particolato? Questa è una domanda tutt’altro che fuori luogo. L’anno scorso alcuni chimici dell’Università di St. Andrews hanno scoperto la presenza di nanoparticelle di diamante insieme ad altri allotropi del carbone all’interno della fiamma di una candela, quali grafite, fullereni e altre particelle amorfe. Pensate che le vostre candele di Natale potrebbero arrivare a produrre oltre 1,5 milioni di nanoparticelle di diamante al secondo, sebbene ciò risulti del tutto inutile per accumulare qualsiasi tipo di ricchezza o per pagare meno tasse, non si potrà più dire che non c’è nulla di valore all’interno della fiamma di una candela, oltre al loro eterno fascino, naturalmente! Infatti questa ricerca suggerisce un nuovo meccanismo di nucleazione per la creazione di diamanti artificiali e di fullereni in un processo di sintesi tramite combustione. Inoltre questa ricerca è stata utilizzata come fonte in uno studio italiano (Università di Napoli – Dip. di Ing. Chimica) sulla caratterizzazione delle nanoparticelle emesse durante la combustione per la comprensione dei loro effetti sulla salute e sull’ambiente.
Un altro studio questa volta condotto in Germania dall’istituto di controllo tecnico della Renania (TÜV Rheinland) ha esaminato il particolato presente nell’aria della Chiesa di San Bonifacio nello Wiesbaden, Germania, sia durante le funzioni che in periodi di chiusura, e in entrambi i casi con e senza il contributo di 50–115 candele di paraffina accese. Uno degli scopi dell’indagine era quello di stabilire il potenziale ruolo che una candela ricopre nello sporcare superficialmente le opere d’arte (vetrate istoriate, mosaici, sculture, dipinti, ecc), nello stesso tempo è stato possibile valutare eventuali problemi che interessano la nostra salute.
I risultati sono stati inequivocabili: le particelle di polvere raccolte nei filtri impiegati nello studio erano imputabili quasi esclusivamente al sistema di riscaldamento della Chiesa, o ai suoi fedeli visitatori, dimostrando che l’influenza delle candele è quasi del tutto trascurabile. Anche per candele fabbricate con cera colorata, o per quelle che erano state immerse in coloranti, non è stato possibile sostenere l’esistenza di alcun rischio per la salute. Solo dopo aver bruciato 30 candele profumate contenenti una percentuale di profumo insolitamente elevata (8%) per quattro ore in una stanza ermetica, gli analisti sono stati in grado di rilevare la presenza di diossine policlorurate e furani, noti attentatori della nostra salute, e anche in questo caso solo a concentrazioni equivalenti al massimo limite tollerato nei luoghi di lavoro.
In ogni caso bisognerebbe sempre fare in modo di evitare la produzione di fumi quando si utilizzano le candele, altrimenti le particelle di fuliggine rilasciate alla fine ricoprirebbero tutto ciò che incontrano precipitando ovunque. Inoltre, la fuliggine si accompagna sempre a piccole quantità di materiali indesiderati, tra cui gli idrocarburi aromatici policiclici che potrebbero essere anche più pericolosi. Allo stesso tempo, possiamo concludere che né in una chiesa, né in un ambiente più casalingo ci potrebbe essere un qualsiasi motivo per associare l’uso delle candele a qualche rischio per la nostra salute.

Fig. 5 - La fiamma di una candela in condizioni di microgravità. Credit: NASA
Di recente abbiamo spedito alcune candele nello spazio per capire come l’assenza di gravità influisce sulla fiamma (e la Nasa suggerisce come ripetere l’esperimento facendo cadere una candela chiusa in un barattolo). Scoprirete che invece di una fiamma a forma a goccia allungata, essa arderà con una fiammella sferica blu (e solo per un breve periodo, dato che la CO2 prodotta non va da nessuna parte e alla fine soffoca la fiamma, proprio come Faraday dimostrò durante le sue lezioni). Un altro trucco da fare con la vostra candela è quello di riaccendere la candela subito dopo averla spenta soffiando, innescando i gas che provengono dallo stoppino. Anche se notate particelle di fuliggine nella colonna di fumo, la presenza di una certa quantità di combustibile e l’introduzione di un cerino sufficientemente vicino allo stoppino, garantiranno un pronto innesco per una rinnovata combustione, viaggiando a ritroso lungo la colonna per riaccendere di nuovo la candela appena soffocata.
In conclusione, come sarebbe oggi la storia di chimica della candela? Forse bisognerebbe rispondere che, oltre al fatto che c’è ancora molto altro lavoro da espletare, la chimica delle candele non è a un binario morto, e soprattutto che a Natale non credo proprio che si possa farne a meno senza rinunciare alla loro poetica atmosfera. Inoltre continuano le pubblicazioni scientifiche che snocciolano ulteriori questioni in corso di approfondimento. Ad esempio, solo qualche settimana fa è stata pubblicata una ricerca che sfrutta la fuliggine della candela come modello per la creazione di una superficie omnifobica, cioè completamente antiaderente e autopulente. (Rif. X Deng et al, Science, 2011, DOI: 10.1126/science.1207115)
Il vero motivo per cui sono state impiegate le candele in questo caso però è da ricercarsi nel periodo in cui il lavoro è stato svolto (lo scorso Natale), quando una fornitura completa di candele avventizie erano rimaste inutilizzate, pronte per fare da cavie alla nuova ricerca. Beh, cosa c’è di meglio a Natale che “vivisezionare” con curiosità una misteriosa candela, piuttosto che torturare un ignaro e tenero topolino da laboratorio?
APPROFONDIMENTI SUL WEB:
Chimicare: Che cos’è il fuoco?
Urto Efficace: Dickens e le Christmas Lectures di Faraday
FONTI:
Roth, K. (2011). Chemistry of the Christmas Candle — Part 1 ChemViews DOI: 10.1002/chemv.201000133
Klaus Roth (2011). Chemistry of the Christmas Candle — Part 2 ChemViews : 10.1002/chemv.201000146
ChemViews (2011). What Makes a Candle Flame? ChemViews : 10.1002/chemv.201000145
L’articolo originale è stato pubblicato in tedesco su:
e tradotto in inglese a cura di W. E. Russey.
Con questo arrangiamento e interpretazione personale non si intende infrangere in alcun modo le leggi sul copyright, lo scopo è espressamente quello di diffondere la cultura della chimica agli interessati con difficoltà di lettura nella lingua inglese o tedesco.
No copyright infringement is intended (for more details please read this site’s disclaimer)
Post originale pubblicato da Gifh su: Il chimico impertinente. Tutti i diritti sul contenuto del blog sono licenziati Creative Commons – Necessario il consenso per la pubblicazione altrove, non per uso commerciale, condividi allo stesso modo.