In fisica e in chimica, la legge delle pressioni parziali di Dalton è la legge che afferma:
La pressione totale esercitata da una miscela ideale di gas ideali, è uguale alla somma delle pressioni parziali che sarebbero esercitate dai gas se fossero presenti da soli in un eguale volume.La pressione parziale di un componente di una miscela di gas è la pressione che questo avrebbe qualora occupasse, da solo, il volume a disposizione dell’intera miscela.
Poniamo il caso di avere due gas, chiamati A e B, la pressione esercitata da ogni singolo gas in un volume uguale sarà rispettivamente:
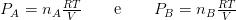
Secondo Dalton quindi, la pressione totale all’interno di quel volume sarà data da:
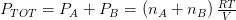
cioè la somma delle loro corrispettive moli per il prodotto della costante R dei gas reali moltiplicata per la temperatura ed il tutto diviso per il volume in esame.
La legge di Dalton e i principi sopra esposti sono di fondamentale importanza nell’attività subacquea. Infatti la quantità di gas (principalmente azoto e ossigeno) disciolti nel sangue è proporzionale alla pressione atmosferica. Ciò significa che all’aumentare della pressione aumenta anche la quantità dei gas disciolti nel sangue. Quindi se ipoteticamente alla pressione di 1 atm (a livello del mare) è presente un litro di azoto disciolto nel sangue, a 10 atm saranno presenti 10 litri di azoto disciolti nel sangue.
La camera iperbarica emula un ambiente come quello dei fondali marini, soggetto a pressione e simulando una “risalita” (cioè diminuendo costantemente la pressione) facilita il riequilibrio tra i gas disciolti e la pressione esterna.

