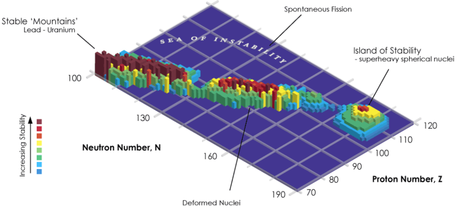
- Una rappresentazione tridimensionale dell’ipotetica isola di stabilità. Imagecredit: Wikimedia Commons
Attualmente possiamo dire di conoscere nel concreto sette periodi della tavola periodica degli elementi chimici, che si chiude, almeno per quanto è stato confermato fino ad ora, con l’Ununoctium, altrimenti chiamato Eka-radon, l’elemento di numero atomico 118. Questo è l’elemento più pesante conosciuto, e ha alcune interessanti peculiarità: la sua collocazione si pone subito sotto il Radon, e come si prevede, dovrebbe avere le caratteristiche elettive dei gas nobili, quindi stato gassoso, elevata stabilità chimica e condizione monoatomica (non forma molecole come O2, H2). Inoltre è il secondo elemento gassoso radioattivo (insieme al radon) e il primo elemento gassoso semiconduttore.
Se ulteriori elementi con numero atomico superiore a questo verranno scoperti in futuro, essi saranno inseriti in ulteriori periodi, disposti (come per i periodi esistenti) in maniera tale da rispettare periodicamente le tendenze ricorrenti nelle proprietà degli elementi in questione.
Senza entrare in ingegneristici tecnicismi, si pensa che questa scoperta sia una porta per l’accesso ad altri elementi successivi con caratteristiche di stabilità particolari, un insieme nel quale si collocano ad esempio l’elio, l’ossigeno, il calcio, lo stagno ed il piombo: tutti hanno in comune un guscio completo di protoni (gli amici e gli addetti ai lavori lo chiamano numero magico!).
Questi elementi “seriali”, fanno presagire che le caratteristiche di quelli successivi, siano tali da presupporre che esista una fascia inesplorata della tavola periodica, definita “isola della stabilità” dove anche elementi con elevati numeri atomici siano più stabili e, quindi in grado di esistere per tempi più lunghi, elementi ancora sconosciuti sul noatro pianeta e che potrebbero aprire nuovi e impensabili sviluppi sia nelle scienze dei materiali che nelle loro applicazioni più tecnologiche.
Eventuali periodi aggiuntivi quindi dovranno essere predisposti ad accogliere un numero maggiore di elementi rispetto al settimo periodo, ma seguendo l’ordine di riempimento degli orbitali si arriva inesorabilmente al completamento dell’orbitale f, ultimo dei quattro orbitali attualmente noti s, p, d, ed f, i quali prendono il nome dalla loro forma (sharp, principal, diffuse, e fundamental).
Così è stato calcolato un ulteriore cosiddetto blocco-G, che contiene altri 18 elementi dal 121 al 138, in cui si riempie parzialmente l’orbitale g, ed è stata suggerita per la prima volta da Glenn T. Seaborg nel 1969.
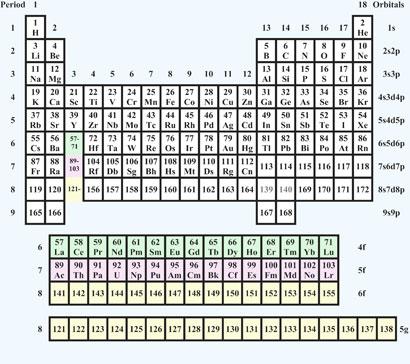
La tavola periodica 2.0. Imagecredit: rsc.org
A questo sistema evoluto si oppongono però il modello atomico di Bohr, che prevede, tramite alcune approssimazioni, che qualsiasi elemento con un numero atomico (Z) superiore a 137 richiederebbe agli elettroni dell’orbitale 1s di viaggiare più veloce di c, la velocità della luce. Quindi un modello non relativistico come il modello di Bohr risulta pertanto inadeguato per tali calcoli.
Allo stesso modo, anche l‘equazione semi-relativistica di Dirac presenta qualche difficoltà. Per Z> 137, la funzione d’onda dello stato fondamentale di Dirac è ondulatoria piuttosto che a pacchetti, e non c’è divario tra gli spettri di energia positiva e negativa, come nel paradosso di Klein. Richard Feynman evidenziò questo effetto, in modo che l’ultimo elemento previsto ai sensi del presente modello, 137 (untriseptium), talvolta viene chiamato feynmanium.
Tuttavia, un calcolo realistico deve tenere conto della estensione finita della distribuzione di carica nucleare. Il risultato è un valore critico di Z ≈ 173 (unseptrium), tale che gli atomi non ionizzati possono essere limitati ad elementi pari o con Z inferiore.

Il prof. Pekka Pyykko
Ora Pekka Pyykkö dell’Università di Helsinki, ha utilizzato un modello computazionale estremamente accurato per predire le strutture elettroniche, e quindi le posizioni nella tavola periodica degli elementi fino ad un numero di protoni pari a 172 – ben oltre il limite di elementi che al momento gli scienziati possono sintetizzare.
I 54 nuovi elementi pesanti giustificati dai calcoli di Pyykkö, esisteranno con proprietà estreme e un’emivita più veloce di un battito di ciglia, ma non lo sapremo con certezza sperimentale fino a quando non saranno sintetizzati.
Peter Schwerdtfeger, un esperto della teoria della struttura elettronica della Massey University di Auckland, in Nuova Zelanda, ha commentato che la chimica sarebbe impensabile senza la tavola periodica degli elementi. Pyykkö ha utilizzato i calcoli relativistici per andare oltre gli elementi già noti, in un territorio completamente sconosciuto.
Inoltre aggiunge che il lavoro in questo settore è oggetto di un vivace dibattito tra gli esperti che sono in disaccordo sulla collocazione di alcuni elementi. Per atomi con cariche nucleari molto elevate, il nucleo può catturare un elettrone orbitante ed emettere un neutrino provocando la diminuzione di un protone, con conseguente arretramento di Z.
Il dibattito potrà essere risolto solo una volta che tutti gli elementi siano stati sintetizzati, ma Pyykkö (e tutti noi) non si aspetta che questo accada tanto presto. «E’ difficile stimare quanto gli sperimentatori procederanno nel corso di questo secolo, forse arriveranno vicino al 130, forse di più. Anche se i risultati sperimentali non compariranno mai, la fisica di base del problema ha già decretato come ‘suoneranno’!», conclude Pyykkö.
Fonti:
- RSCPublishing - Extended elements: new periodic table - DOI: 10.1039/c0cp01575j
- Wikipedia - Extended periodic table







