 Entriamo nell’antro dei supereroi atomici, silenziosamente mi raccomando, perché sono dei tipi molto irritabili e le loro reazioni, a volte, si palesano in maniera spropositata e alquanto dirompente per noi comuni mortali!
Entriamo nell’antro dei supereroi atomici, silenziosamente mi raccomando, perché sono dei tipi molto irritabili e le loro reazioni, a volte, si palesano in maniera spropositata e alquanto dirompente per noi comuni mortali!
Di cosa sto parlando? Ma della famiglia dei nuovi protagonisti dei palcoscenici della chimica, sono sulla bocca di tutti gli addetti ai lavori: incredibili aggregati di atomi, particolarmente dotati nell’imitazione delle proprietà di specie atomiche già affermate sulle scene, come gli alogeni, spesso superandone le peculiarità e lasciando scoprire che alcuni limiti non attendevano altro per essere infranti. Ecco le nuove star delle ultime frontiere della chimica!
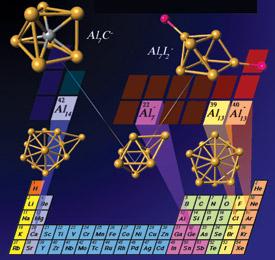
Diversi cluster di alluminio (le strutture in basso) mostrano un comportamento simile a quello di specifici tipi atomici, come gli alogeni e gli alcalino-terrosi. Courtesy of S. Khanna. Source: ACS
I superatomi sono aggregati, o meglio cluster atomici, che mostrano di possedere proprietà simili a quelle di alcune famiglie di elementi, e sono stati (ri)scoperti nel 2004, quando alcuni ricercatori capeggiati da S. N. Khanna, della Virginia Commonwealth University, dimostrarono l’evidenza delle caratteristiche da superalogeno del cluster molecolare di formula Al13I-.
Facciamo un passo indietro, gli alogeni sono dei generatori di sali, come suggerisce il nome proveniente dal greco, e si trovano sulla tavola periodica lungo una fila verticale, subito a destra dei gas nobili. A questo gruppo (il diciassettesimo) appartengono i famigerati fluoro, cloro, bromo, iodio e astato, e la loro reattività si spiega con una proprietà chiamata elettronegatività. Questa, rappresentata da un valore numerico, esprime la forza con cui questi atomi attirano gli elettroni verso di sé, quando si trovano a socializzare con un metallo, il quale a sua volta non vede l’ora di cederglielo per legarsi, un po’ quello che succede tra una ragazza che ha deciso di maritarsi e il povero malcapitato di turno!
Per completare il quadro, è necessario introdurre anche i concetti di energia di ionizzazione e affinità elettronica, che indicano rispettivamente l’energia necessaria per liberarsi di un elettrone, e la quantità di energia rilasciata in questa operazione. Scrutando la tavola periodica scopriamo che il fluoro è l’elemento più elettronegativo, mentre il cloro è quello con la più elevata affinità elettronica di tutti, pari a 349 kJ/mol o 3,6 elettronvolt.
Infatti il cloro è alla perenne ricerca di un elettrone facile, e dato che negli ambienti da lui frequentati pullulano gli atomi inquieti di sodio, quelle lamentose particelle della pubblicità che non vedono l’ora di disfarsi del loro fardello, non fanno altro che fornicare insieme scambiandosi gli elettroni, per garantirci infinite riserve di sale per cucinare e per tenere sgombre le strade dal ghiaccio durante l’inverno. “Un matrimonio perfetto” come dice scherzando Puru Jena, Ph.D e professore alla Virginia Commonwealth University!
Agli alogeni basta un elettrone per diventare felici, e sono molto più stabili quando sono negativi rispetto a quando si trovano in una condizione neutrale.
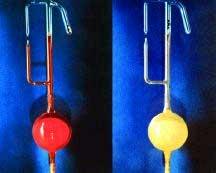
Quando l'esafluoruro di platino, un gas di colore rosso (a sinistra), reagisce con un eccesso di xeno, il prodotto risultante è un solido giallo di formula bruta XePtF6 (a destra), noto come il primo composto stabile di un gas nobile.
Nel 1962, il chimico inglese Neil Bartlett ha scoperto che l’esafluoruro di platino reagisce con lo xeno per formare il primo composto di gas nobile conosciuto. Gli scienziati rimasero stupefatti perché lo xeno appartiene ad un gruppo di elementi estremamente stabili, tanto da guadagnarsi l’appellativo di gas “nobili”, per la scarsissima propensione a legarsi con altri atomi, perfino tra di loro, tanto da essere gli unici gas che si trovano in natura a rimanere preferenzialmente monoatomici.
Una dozzina di anni dopo, due scienziati sovietici, Gennady Gutsev e Alexander Boldyrev, hanno dimostrato che una classe più ampia di molecole con un atomo di metallo al centro circondato da atomi di alogeni, in analogia con l’esafluoruro di platino, possedeva un’affinità elettronica perfino superiore di quella del cloro. Queste molecole sono state chiamate “superalogeni”.
Ad esempio, potreste prendere un atomo di sodio e un atomo di cloro per costruire una molecola di cloruro di sodio e quindi attaccargli forzatamente un secondo atomo di cloro. Questo nuovo composto quindi diventerebbe nuovamente “affamato” di elettroni a causa del secondo atomo di cloro aggiunto. All’improvviso, l’affinità elettronica, che è la caratteristica che ci interessa, arriva a raggiungere un valore quasi doppio rispetto al cloro. Così diventa un superalogeno, un superatomo con proprietà degli alogeni potenziate, un supereroe della tabella periodica.
Jena, insieme a Anil Kandalam, Ph.D., professore assistente presso la McNeese State University, ha teorizzato che si potrebbe spingere l’affinità elettronica di un cluster o di una molecola verso livelli ancora maggiori, utilizzando i superalogeni come materia prima per la costruzione, al posto degli alogeni, per circondare l’ignaro atomo metallico. Il modello teorico è stato testato attraverso studi sperimentali condotti da Gerd F. Ganteför, Ph.D., presso la University of Konstanz. La nuova famiglia che entra a far parte di questa portentosa serie con affinità elettroniche estremamente elevate, è stata battezzata iperalogeni, una quarta dimensione nello spazio delle molecole complesse.
Il professor Jena rivela come sia stato impiegato un atomo di oro, nella parte del metallo, che è stato circondato da due superalogeni (boro-biossido), ottenendo un iperalogeno con una affinità elettronica ancora più grande.
L’approccio sinergico del team che coinvolge una fase teorica e una sperimentale, ha prodotto un iperalogeno di oro-borato con una affinità elettronica di 5,7 eV. I ricercatori sono ora al lavoro su un iperalogeno costruito con quattro superalogeni di boro-biossido e hanno già raggiunto un affinità elettronica di 7 eV, con l’obiettivo di costruire un iperalogeno da 10 eV. Questi nuovi aggregati molecolari chiamati iperalogeni potrebbero portare a ulteriori scoperte di nuovi composti chimici dalle proprietà imprevedibili.
Le indagini teoriche per il progetto sono state condotte da Jena e da Mary Willis presso la VCU, insieme a Kandalam. Il lavoro sperimentale è stato eseguito da Ganteför e Matthias Götz, dottorando presso la University of Konstanz.
