
Quando rompiamo un uovo e lasciamo che albume e tuorlo riempiano una pentola, verosimilmente non ci poniamo altro obiettivo se non quello di cucinare qualcosa di buono. In realtà, dietro a questa banale operazione, si cela un intero mondo: quello dell'entropia (dal greco entropé, che significa “conversione, confusione”). Il termine, ben noto agli scienziati, ma astruso per la maggior parte delle persone che non ha mai masticato un po' di fisica, viene affrontato per la prima volta da Rudolf Clausius nel suo Trattato sulla teoria della meccanica del calore pubblicato nel 1864. Si rifà a una teoria secondo la quale ogni tipo di trasformazione avviene in una sola direzione, verso il maggior disordine; mentre non accade mai il fenomeno contrario. Immaginiamo un recipiente colmo di un gas che indichiamo con la lettera A e un altro riempito con il gas B. A un certo punto apriamo una fessura consentendo ai due gas di venirsi incontro e fondersi fra loro. Dall'incontro fra le varie molecole si instaura un grado di disordine massimo. Dunque l'entropia misura questo parametro; si ha, perciò, una minore entropia quando il disordine è minimo e una entropia massima quando il disordine è totale. Si possono fare molti altri esempi, come una goccia di inchiostro che scivola in un bicchiere d'acqua, o del caffè che viene versato in una tazza di latte. In entrambi i casi si passa da una condizione di ordine al disordine, con un'impennata dell'entropia. Si può fare un altro esempio prendendo come riferimento una boccetta di profumo: nello stadio iniziale le molecole isolate dall''universo' sono ordinate e con bassa entropia; ma se togliamo il tappo evaporano, raggiungendo il disordine e il cosiddetto equilibrio dinamico. E si può far riferimento perfino all'universo, considerando che da un ordine iniziale, l'espansione a cui è sottoposto in seguito al big bang, fa sì che ci sia un continuo aumento del disordine e dell'entropia. Perché non si può tornare allo stato originale? Perché a fronte di un solo stato di ordine vi sono miliardi di miliardi di miliardi di stati di disordine possibili. Tutti questi processi, come si può facilmente intuire, sono irreversibili e seguono inevitabilmente la freccia del tempo. Questo vuol dire che il processo inverso (per esempio la separazione dei due gas A e B nei due recipienti) non avviene spontaneamente in natura. Se da un lato l’entropia viene, dunque, usualmente associata al disordine, la sua definizione termodinamica è invece basata sul concetto di calore. Il calore può essere definito come il trasferimento di energia termica (forma di energia che caratterizza ogni corpo dotato di una certa temperatura superiore allo zero assoluto) da un corpo all'altro. Da ciò dipendono numerosi aspetti della fisica e, quindi, dei tanti fenomeni naturali che ci riguardano anche in prima persona. I primi ad associare il calore all'energia, e non più quindi al fantomatico fluido invisibile detto “calorico”, furono a cavallo fra il Settecento e l'Ottocento Benjamin Thompson, Humphry Davy e James Prescott Joule. Con essi si gettano le basi della termodinamica. Ma cosa si intende con questo termine? Si riferisce a una branca della fisica finalizzata allo studio delle trasformazioni subite da un “sistema”, successive a un processo di scambio di energia con altri sistemi o con l'ambiente che ci circonda. Il primo a capire che si potesse ottenere forza lavoro da uno scambio energetico in cui fosse coinvolto il calore fu Nicolas Léonard Sadi Carnot, nel 1824. Ha appena 28 anni quando pubblica Réflexions sur la puissance due feu (Riflessioni sulla potenza motrice del fuoco). Ma il primo principio della termodinamica – detto anche legge di conservazione dell'energia – è opera di Joule. Attua il seguente esperimento, lasciando cadere in un recipiente adiabatico (sistema che non può scambiare calore con l'esterno) un peso collegato a un'asta verticale tramite una corda, registrando un aumento della temperatura del liquido dovuta all'attrito dell'oggetto in esso precipitato. È la conferma che l’energia può assumere varie forme (lavoro, calore) fra loro equivalenti. Poco più tardi, grazie alle intuizioni di Carnot, ma attraverso gli studi di Clausius, si giunge alla seconda legge della termodinamica, caposaldo della fisica moderna, che pone dei limiti al passaggio di energia da una forma all’altra.
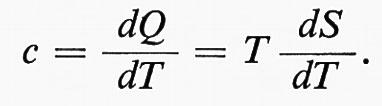 La seconda legge delle termodinamica prende spunto dal fatto che il calore fluisce naturalmente da una sorgente più calda a una più fredda. Il processo contrario non si verifica mai. (Se si esclude il mondo microscopico e i cosiddetti “moti browniani”). È stabilita dalla seguente “formulazione” espressa da Kelvin-Planck: “È impossibile realizzare una trasformazione il cui unico risultato sia la conversione in lavoro del calore fornito da una sorgente a temperatura uniforme”. Il fenomeno concerne il fatto che il rendimento di un qualunque motore termico soggiace alla regola tale per cui solo una parte dell'energia termica del combustibile si trasforma in lavoro utile; una parte viene inevitabilmente trasferita all’ambiente circostante come calore, e non e’ più utilizzabile. Empiricamente è lecito aspettarsi che circa un terzo del contenuto energetico di una fonte di calore si può trasformare in un'altra forma energetica, per esempio l'energia elettrica. In che modo, quindi, c'è relazione fra entropia e secondo principio della termodinamica? Immaginiamo un sistema termodinamico qualsiasi in equilibrio nello stato A. Lo vogliano “traslare” nel punto B attraverso un processo irreversibile (proprio dell'entropia) per poi ritornare allo stadio A con un processo reversibile. Il ciclo completo viene spiegato dalla relazione 1. Ma sappiamo che 2 corrisponde alla differenza di entropia evidenziata da Clausius (3), quindi si arriva a ottenere 4: la nuova relazione evidenzia che l'integrale non corrisponde alla variazione di entropia fra i due stati A e B essendo di valore inferiore. È ammissibile, dunque, l'uguaglianza 5 nel momento in cui la trasformazione analizzata è reversibile. In tal caso l'integrale sarebbe nullo e non ci sarebbe, di fatto, aumento di entropia. Dunque la relazione dQ/T diviene zero portando a 6 e di conseguenza a 7. Tutto ciò indica che l'entropia non può diminuire ma solo aumentare se la trasformazione è irreversibile e rimanere costante se quest'ultima è reversibile. E si arriva al risultato finale: 8. Da qui il concetto può essere ampliato considerando l'esistenza di un sistema che scambia calore con l'ambiente circostante, vale a dire non isolato, nell'ambito del cosiddetto universo termodinamico: e si hanno 9 e 10. Ora che si è arrivati alla formula finale si può capire perché è utile comprendere l'ordine e il disordine delle cose, benché molti scienziati ammettano che l'entropia possa essere assimilabile a una grandezza fisica anomala, dove “non vale un principio di conservazione, ma un principio di non conservazione”. In pratica il secondo principio della termodinamica afferma che quando si ha un processo spontaneo si ha aumento di entropia. «I processi spontanei, come anche quelli inventati dall’uomo per le sue molteplici attività», spiega Piero Chiaradia, fisico dell'Università Tor Vergata di Roma, «sono tutti irreversibili, essendo soggetti alle limitazioni del secondo principio e comportando aumenti di entropia dell’universo. Se fossimo invece capaci di eseguire quelle stesse trasformazioni termodinamiche in modo reversibile, allora per esse non esisterebbe il secondo principio e l’entropia rimarrebbe costante. Questo però è un sogno irrealizzabile». La seconda legge della termodinamica ci dice che la produzione di lavoro è sempre accompagnata dalla trasformazione di energia “pregiata”, cioè calore ad alta temperatura, in energia “degradata”, il calore a bassa temperatura, che non è ritrasformabile. In pratica si perde per sempre. In particolare, nel caso dell'universo, una volta che tutte le trasformazioni energetiche possibili avranno avuto luogo, si assisterà alla morte termica del cosmo, con la scomparsa di ogni forma vivente. La seconda legge della termodinamica ci dice anche che l'energia ha dei paletti e non può trasformarsi liberamente da una forma all'altra. E ci richiama al fatto che ogni trasformazione fisica avviene in un verso bene preciso: una palla che rimbalza, si fermerà per via dell'attrito (mentre non può, da ferma, mettersi a “saltellare”); l'acqua presente in un bicchiere tenderà a evaporare, ma il processo contrario non è ammissibile; un tuffatore che si butta in piscina, non può tornare indietro a metà percorso. E tutto è in funzione del tempo. Tutti fenomeni analizzati, infatti, si verificano in seguito al trascorrere dei minuti, delle ore e via dicendo. È in pratica l'entropia che consente di dare un senso alle parole “passato” e “futuro”. L'entropia, infine, ci aiuta a comprendere fenomeni di ampio spettro come l'inquinamento. Siamo infatti impegnati tutto il giorno a sistemare le cose, a mettere in ordine: la cucina, la camera, i fogli sulla scrivania; spazziamo le foglie e leviamo la polvere dai mobili. Ma non ci rendiamo conto che, così facendo, diminuiamo il disordine a noi familiare, aumentando quello dell'ambiente circostante. Dunque l'inquinamento può essere considerato come l'aumento di entropia nell'ambiente provocato dalla nostra attività quotidiana. Mettiamo a posto la casa, ma creiamo disordine tutt'intorno.
La seconda legge delle termodinamica prende spunto dal fatto che il calore fluisce naturalmente da una sorgente più calda a una più fredda. Il processo contrario non si verifica mai. (Se si esclude il mondo microscopico e i cosiddetti “moti browniani”). È stabilita dalla seguente “formulazione” espressa da Kelvin-Planck: “È impossibile realizzare una trasformazione il cui unico risultato sia la conversione in lavoro del calore fornito da una sorgente a temperatura uniforme”. Il fenomeno concerne il fatto che il rendimento di un qualunque motore termico soggiace alla regola tale per cui solo una parte dell'energia termica del combustibile si trasforma in lavoro utile; una parte viene inevitabilmente trasferita all’ambiente circostante come calore, e non e’ più utilizzabile. Empiricamente è lecito aspettarsi che circa un terzo del contenuto energetico di una fonte di calore si può trasformare in un'altra forma energetica, per esempio l'energia elettrica. In che modo, quindi, c'è relazione fra entropia e secondo principio della termodinamica? Immaginiamo un sistema termodinamico qualsiasi in equilibrio nello stato A. Lo vogliano “traslare” nel punto B attraverso un processo irreversibile (proprio dell'entropia) per poi ritornare allo stadio A con un processo reversibile. Il ciclo completo viene spiegato dalla relazione 1. Ma sappiamo che 2 corrisponde alla differenza di entropia evidenziata da Clausius (3), quindi si arriva a ottenere 4: la nuova relazione evidenzia che l'integrale non corrisponde alla variazione di entropia fra i due stati A e B essendo di valore inferiore. È ammissibile, dunque, l'uguaglianza 5 nel momento in cui la trasformazione analizzata è reversibile. In tal caso l'integrale sarebbe nullo e non ci sarebbe, di fatto, aumento di entropia. Dunque la relazione dQ/T diviene zero portando a 6 e di conseguenza a 7. Tutto ciò indica che l'entropia non può diminuire ma solo aumentare se la trasformazione è irreversibile e rimanere costante se quest'ultima è reversibile. E si arriva al risultato finale: 8. Da qui il concetto può essere ampliato considerando l'esistenza di un sistema che scambia calore con l'ambiente circostante, vale a dire non isolato, nell'ambito del cosiddetto universo termodinamico: e si hanno 9 e 10. Ora che si è arrivati alla formula finale si può capire perché è utile comprendere l'ordine e il disordine delle cose, benché molti scienziati ammettano che l'entropia possa essere assimilabile a una grandezza fisica anomala, dove “non vale un principio di conservazione, ma un principio di non conservazione”. In pratica il secondo principio della termodinamica afferma che quando si ha un processo spontaneo si ha aumento di entropia. «I processi spontanei, come anche quelli inventati dall’uomo per le sue molteplici attività», spiega Piero Chiaradia, fisico dell'Università Tor Vergata di Roma, «sono tutti irreversibili, essendo soggetti alle limitazioni del secondo principio e comportando aumenti di entropia dell’universo. Se fossimo invece capaci di eseguire quelle stesse trasformazioni termodinamiche in modo reversibile, allora per esse non esisterebbe il secondo principio e l’entropia rimarrebbe costante. Questo però è un sogno irrealizzabile». La seconda legge della termodinamica ci dice che la produzione di lavoro è sempre accompagnata dalla trasformazione di energia “pregiata”, cioè calore ad alta temperatura, in energia “degradata”, il calore a bassa temperatura, che non è ritrasformabile. In pratica si perde per sempre. In particolare, nel caso dell'universo, una volta che tutte le trasformazioni energetiche possibili avranno avuto luogo, si assisterà alla morte termica del cosmo, con la scomparsa di ogni forma vivente. La seconda legge della termodinamica ci dice anche che l'energia ha dei paletti e non può trasformarsi liberamente da una forma all'altra. E ci richiama al fatto che ogni trasformazione fisica avviene in un verso bene preciso: una palla che rimbalza, si fermerà per via dell'attrito (mentre non può, da ferma, mettersi a “saltellare”); l'acqua presente in un bicchiere tenderà a evaporare, ma il processo contrario non è ammissibile; un tuffatore che si butta in piscina, non può tornare indietro a metà percorso. E tutto è in funzione del tempo. Tutti fenomeni analizzati, infatti, si verificano in seguito al trascorrere dei minuti, delle ore e via dicendo. È in pratica l'entropia che consente di dare un senso alle parole “passato” e “futuro”. L'entropia, infine, ci aiuta a comprendere fenomeni di ampio spettro come l'inquinamento. Siamo infatti impegnati tutto il giorno a sistemare le cose, a mettere in ordine: la cucina, la camera, i fogli sulla scrivania; spazziamo le foglie e leviamo la polvere dai mobili. Ma non ci rendiamo conto che, così facendo, diminuiamo il disordine a noi familiare, aumentando quello dell'ambiente circostante. Dunque l'inquinamento può essere considerato come l'aumento di entropia nell'ambiente provocato dalla nostra attività quotidiana. Mettiamo a posto la casa, ma creiamo disordine tutt'intorno.







