Andromeda, il malefico virus del film omonimo, 1971
La ricerca scientifica che si occupa di verificare l’esistenza di intelligenza extraterrestre, nota con l’acronimo SETI, si basa essenzialmente su rilevazioni di onde elettromagnetiche, per la maggior parte onde radio, ma anche nell’infrarosso o nelle bande dei raggi X, oltre a impulsi ottici caratterizzati da particolari frequenze. Questo riduzionismo esplorativo ovviamente non copre che una parte molto limitata dello spettro a varietà incognita che ci troviamo a fronteggiare, in pratica stiamo cercando un pagliaio con un ago…
Sembrerebbe quasi che oltre un secolo di fantascienza dedicata agli alieni non sia riuscita nell’intento di ampliare gli orizzonti dei ricercatori, colpevole forse di aver calcato troppi cliché stereotipati che dipingono i “diversamente terrestri” esattamente come noi, o al massimo con (più o meno lievi) alterazioni morfologiche, suggerendo così un modello di vita intelligente basato sulla nostra immagine che dimostra tutto il nostro antropocentrismo. Di certo le eccezioni non mancano: numerosi, anche se isolati, sono i tentativi di descrivere forme di vita veramente aliene, che di antropomorfo non conservano più nulla e che della chimica organica se ne infischiano, forme di vita che rientrano a fatica anche nella definizione di vita stessa arrivando al concepimento di impossibili pronipoti di precedenti civiltà ormai estinte, con percorsi variegati, fino al raggiungimento di livelli evolutivi che vanno oltre il concetto di essere vivente, come noi possiamo intenderlo.
Fortunatamente, dato il fascino dell’argomento, numerosi scienziati coraggiosi si sono impegnati anche nell’esplorazione di possibili forme di vita non convenzionali, ipotizzando sistemi complessi basati su biochimiche alternative che potrebbero adattarsi in modo più efficace eludendo le ristrette limitazioni delle cosiddette Cinture Verdi, ovvero quelle regioni dello spazio le cui condizioni favoriscono lo sviluppo della vita di tipo terrestre. D’altronde anche sulla Terra abbiamo esempi eclatanti di quanto estremo possa essere vivere in laghi pregni di arsenico, fosse oceaniche con pressioni eccezionali, vulcani e altre fonti geotermiche, freddi estremi e perfino ambienti radioattivi.

Scorcio delle spiagge di una luna di Saturno
Appare evidente che tutto ruoti attorno all’assunzione che la vita sia un sistema chimico complesso in grado di compiere un’evoluzione di tipo Darwiniano e possa esistere in una vasta gamma di condizioni ambientali. Nulla vieta però l’inclusione di sistemi basati su solventi diversi dall’acqua a basse o alte temperature o perfino di miscele supercritiche elio-idrogeno. Gli unici requisiti inevitabili potrebbero essere un disequilibrio termodinamico e temperature che consentano la formazione di legami chimici. Se poi ci inoltriamo chimico-fisicamente, potremmo aver bisogno di un sistema solvente, abbondanza di elementi come carbonio, idrogeno, ossigeno e azoto, oltre ad un percorso metabolico per ricavare energia e un sistema efficace di autoreplicazione. Una rassegna dei principali studi scientifici sull’argomento condotta da Steven A. Benner, Alonso Ricardo e Matthew A. Carrigan e pubblicata nel 2004 da Current Opinion in Chemical Biology conclude che la vita potrebbe verificarsi anche in condizioni più estreme di quanto possiamo immaginare, compresi sistemi non acquosi come quelli presenti su Titano, un satellite di Saturno, dove esisterebbero oceani di idrocarburi alifatici, che vanno dal più semplice, il metano, fino agli omologhi maggiori, etano, propano, butano, ecc., relativamente abbondanti nel sistema solare. Le temperature di ebollizione di questi solventi non polari, spaziano da 109 a 349 K, a pressione normale, quindi Titano potrebbe ospitare mari di etano e metano in forma liquida e in barba alla rima si sgancerebbe dal paradigma antropocentrico lasciando ipotizzare una reattività nei mezzi idrocarburici non meno versatile di quella a base acquosa. Infatti possiamo portare come analogia acquisita il fatto che molti enzimi terrestri catalizzano reazioni tramite un sito attivo che non sfrutta il mezzo acquoso, come sembrerebbe nel caso della scissione dei peptidi da parte della chimotripsina e della carbossipeptidasi.
Inoltre il legame idrogeno è di difficile impiego nell’assemblaggio di strutture supramolecolari in un mezzo acquoso. Usando etano come solvente, un’ipotetica forma di vita dovrebbe essere in grado di sfruttare meglio le potenzialità di questo legame, raggiungendo ad esempio la forza necessaria alle molecole per contrastare temperature estremamente basse. Idrocarburi con gruppi polari inoltre potrebbero essere idrocarburofobici, come l’acetonitrile e l’esano per esempio, che formano due fasi distinte. Possiamo così anche lasciarci andare a ipotesi controverse come un DNA basato sull’arsenico al posto del fosforo, le cui principali evidenze contestate durante il celebre arsenic-gate della NASA, erano quelle di un’instabilità di tipo idrolitico che escludeva una struttura molecolare troppo fragile per una vita a matrice acquosa.
La reattività dell’acqua implica che essa distrugge facilmente specie organiche instabili tramite l’idrolisi, ma una eventuale forma di vita che alberghi negli oceani idrocarburici di Titano non sarebbe molto preoccupata della deaminazione idrolitica delle sue basi nucleiche e sarebbe in grado di gestire più abilmente le proprie reattività rispetto alla sopravvivenza in un mezzo acquoso. Questo vale anche per gran parte dei chimici organici che si occupano di sintesi, i quali preferiscono solventi diversi dall’acqua nell’80% dei casi, evidenziando come solventi non polari sono la migliore scelta per trattare con le reattività dei complessi organici.
Oltre gli idrocarburi
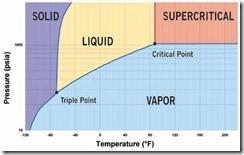
Diagramma di fase del biossido di carbonio
La supremazia in termini di abbondanza nel sistema solare di idrogeno molecolare (presente per l’86%), è accompagnata da minoranze di altri componenti come l’elio (0,14%), il metano (0,002 %), acqua (6 x 10-4 % ), ammoniaca (2,5 x 10-4 % ) e solfuro di idrogeno (7 x 10-5 % ). Eccetto l’acqua, si tratta di sostanze che alle temperature tipiche delle zone abitabili sono presenti in forme gassose. Le proprietà fisiche di una sostanza sono descritte dai diagrammi di fase che relazionano lo stato di aggregazione (solido, liquido o gassoso), a temperatura e pressione. Di solito è sempre presente una linea in tali diagrammi che li attraversano completamente, dove nella parte superiore troviamo la fase gassosa e in quella inferiore la fase liquida. Normalmente la linea termina con un punto critico oltre il quale la sostanza entra nello stato di fluido supercritico, cioè intermedio tra gas e liquido, ma diverso da entrambi. Nella tabella che segue si riportano le temperature e le pressioni critiche di alcune sostanze comuni presenti nel sistema solare. Le proprietà dai fluidi supercritici differiscono da quelle dei fluidi ordinari, per esempio l’acqua nel suo stato supercritico è relativamente apolare e il suo pH tende all’acidità. Inoltre le proprietà di tali fluidi, come densità e viscosità, cambiano repentinamente all’avvicinarsi nei pressi del punto critico. I fluidi supercritici proprio grazie alle loro inusuali proprietà solvatanti trovano diverse applicazioni in campo industriale, come ad esempio nel caso del biossido di carbonio, il quale è caratterizzato da una temperatura critica di 304,2 K e una pressione critica di 73,8 atmosfere ben prestandosi alla decaffeinizzazione del caffe.
Poche sono le nostre osservazioni relative al comportamento delle molecole organiche immerse in idrogeno allo stato supercritico come solvente. Negli anni ‘50 e ‘60, diversi laboratori hanno indagato sulla solubilità di molecole organiche come il naftalene in gas compressi, idrogeno ed elio inclusi, non toccando tuttavia pressioni troppo elevate e temperature estreme. L’applicazione di queste esperienze comunque, considerando pianeti gassosi giganti dove l’idrogeno diventa stabile nella sua fase supercritica, lascia ipotizzare almeno due limiti in cui la temperatura non escluda automaticamente la stabilità di legami covalenti carbonio-carbonio. Il primo si trova in corrispondenza del raggio che consente il raggiungimento della fase supercritica dell’idrogeno e il secondo nel raggio che definisce la temperatura oltre il quale le molecole organiche non sono più stabili, nella fattispecie è stata scelta intorno ai 500 K. Se il secondo raggio è più piccolo del primo, allora la zona abitabile del gigante gassoso esiste secondo questi criteri per forme di vite adatte a un ambiente di idrogeno supercritico, mentre se è vero il contrario, cioè il secondo raggio è maggiore del primo, allora il pianeta non offre alcuna zona abitabile.
Liquido Temperatura critica (K) Pressione critica (atm)
Idrogeno 33,3 12,8
Neon 44,4 26,3
Azoto 126 33,5
Argo 151 48,5
Metano 191 45,8
Etano 305 48,2
Biossido di carbonio 305 72,9
Ammoniaca 406 112
Acqua 647 218
Se una tale zona esistesse su Giove, dovrebbe essere molto ristretta, mentre per Saturno, Urano e Nettuno questa potrebbe apparire più spessa in relazione al raggio planetario. Le atmosfere di questi pianeti sono animate da moti convettivi, per sopravvivere su Giove ad esempio, una ipotetica vita basata su legami covalenti del carbonio necessiterebbe di evitare di essere spostata per convezione verso posizioni in cui tale vita non è più sostenibile. Questo naturalmente è vero per qualsiasi ambiente fluido, anche per gli oceani terrestri. Carl Sagan e Salpeter hanno presentato una discussione dettagliata di ciò che potrebbe essere necessario affinché una vita fluttuante possa rimanere stabile nell’atmosfera del pianeta più grande del nostro sistema stellare, e non può essere ignorata.
Solventi non convenzionali
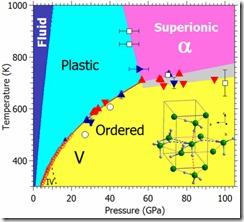
Diagramma di fase dell’ammoniaca
Nel 1954 J.B.S. Haldane, considerato uno dei fondatori della moderna sintesi evoluzionistica, relazionando al simposio sull’origine della vita suggerì che biochimiche alternative potrebbero essere possibili sostituendo l’acqua con ammoniaca liquida. In parte il ragionamento era basato sull’osservazione delle analogie tra acqua e ammoniaca, ad esempio l’analogo ammoniacale del metanolo, CH3OH è la metilammina, CH3NH2. Haldane teorizza che potrebbe essere possibile l’esistenza di controparti basate sull’ammoniaca di sostanze complesse, come proteine e acidi nucleici, sfruttando il fatto che un intera classe di composti organici, i peptidi, potrebbero esistere senza variazioni in un sistema basato sull’ammoniaca. Le ammidi che sostituirebbero i consueti aminoacidi, potrebbero quindi essere soggette a condensazione per formare polipeptidi, un percorso quasi identico nella forma a quelli che si verificano nelle forme di vita terrestri. Questa ipotesi, che in seguito fu sviluppata ulteriormente dall’astronomo inglese V. Axel Firsoff, acquisisce un interesse particolare quando si considerano le possibilità di evoluzioni biologiche su pianeti ricchi di ammoniaca come i giganti gassosi e i loro satelliti. L’ammoniaca inoltre possiede similarità chimiche strategiche con l’acqua, come il potere solvente per molte sostanze organiche che si attua anche meglio dell’acqua stessa, oltre alla capacità di dissolvere molti altri elementi, come iodio, zolfo, selenio e fosforo, pur con minime reattività. Ciascuno di questi elementi è essenziale per la chimica della vita e per i percorsi della sintesi prebiotica. Spesso si eleva l’obiezione che l’ammoniaca è liquida in condizioni più ristrette rispetto all’acqua, limitandone il raggio d’azione. Tuttavia bisogna tener conto, come abbiamo visto nel paragrafo precedente, che il campo si può estendere in virtù della pressione all’interno di un diagramma di fase, ad esempio con 60 atmosfere, una pressione inferiore a quella disponibile su Venere, l’ammoniaca bolle a 98°C anziché -33°C, conferendo una fase liquida che si estende fino a 175°, lasciando così spazio anche a forme di vita che non necessariamente debbano rasentare il congelamento.
L’ammoniaca inoltre possiede una costante dielettrica di circa un quarto rispetto a quella dell’acqua, rendendola un isolante molto più debole. D’altra parte il suo calore di fusione è più alto, quindi è relativamente più difficile congelarla oltre il suo punto di fusione. Il calore specifico dell’ammoniaca è leggermente più alto di quello dell’acqua, e la sua viscosità è di gran lunga inferiore. La chimica delle interazioni acido-base dell’ammoniaca liquida è stata ampiamente esplorata, ed è stato dimostrato come essa sia altrettanto ricca nei suoi dettagli di quella dei sistemi acquosi, lasciando difficilmente pensare che essa sia inferiore all’acqua nelle sue potenzialità di supporto alla vita. Probabilmente esistono anche più possibilità in sistemi a base carbonio-ammoniaca di quelli basati su carbonio-acqua, dato che il solvente vitale per una forma di vita dovrebbe essere in grado di dissociarsi in anioni e cationi in modo da consentire il verificarsi di reazioni acido-base. Nel sistema a solvente ammoniacale, acidi e basi sono diversi dai sistemi acquosi, proprio perché i concetti di acido e base dipendono dal mezzo in cui sono disciolti.

Il magnifico Zuckuss, in tutto il suo insettoide splendore
Nei sistemi ammoniacali, l’acqua, che reagisce con l’ammoniaca liquida per formare ioni NH4+, potrebbe apparire come un acido forte, cioè un composto ostile alla vita. In effetti l’ammoniaca liquida viene spesso usata come solvente per ospitare reazioni di riduzione in presenza di forti riducenti (sodio metallico) che altrimenti, in acqua, reagirebbero immediatamente. Di conseguenza è possibile costruire una nuova scala di pH a partire dalla costante di autoprotolisi dell’ammoniaca (2 NH3 ↔ NH2- + NH4+ pKa = 27) e una nuova scala di potenziali standard. Ovviamente una biochimica basata sull’ammoniaca liquida implicherebbe numerose differenze sostanziali nei suoi particolari biochimici, tuttavia come alcuni ipotizzano, forme di vita di tal fattura potrebbero sfruttare cloruri di cesio e rubidio per regolare i potenziali elettrici delle membrane cellulari, grazie alla loro maggiore solubilità nell’ammoniaca liquida rispetto a sali di sodio e potassio che costituiscono il caso terrestre.
Esempi di forme di vita basate sull’ammoniaca nella fantascienza non mancano di certo, Robert Forward, fisico e scrittore statunitense, nella sua saga Rocheworld specula su una biochimica di tipo terrestre che sfrutta una miscela di acqua e ammoniaca come solvente e immagina coloratissime meduse giganti che popolano gli oceani ammoniacali di Eau, dividendosi tra divertenti cavalcate sulle onde e appassionanti problemi matematici. Sicuramente rientrerà tra le mie prossime letture! Anche in Guerre Stellari: L’impero colpisce ancora ci viene mostrato Zuckuss, un cacciatore di taglie membro della specie Gand, una forma di vita insettoide basata sull’ammoniaca che interloquisce tramite una flatulenza modulata. Meglio non scendere in ulteriori dettagli…
Mondi altamente corrosivi e fluoro in quantità
Il fluoruro di idrogeno, come l’acqua, è una molecola polare e proprio a causa della sua polarità è in grado di dissolvere molti composti ionici. Il suo punto di fusione è di -84°C e quello di ebollizione si trova a 19,54°C a pressione normale, garantendo un differenziale simile a quello dell’acqua. Inoltre anche il fluoruro di idrogeno, notoriamente utilizzato per dissolvere composti del silicio, gode dell’effetto dei legami idrogeno con molecole in sua prossimità, rendendolo un possibile candidato per supportare la vita su altri pianeti. Il fluoro potrebbe fungere da accettore di elettroni per produrre energia fotosintetica, nonostante la sua pericolosità per sistemi organici di tipo terrestre, anche se le paraffine non sembrerebbero accorgersene, risultando pertanto stabili. La presenza di grandi quantità di acido fluoridrico su scala planetaria però, è possibile solo in una gamma di temperature compresa tra l’acqua liquida e la sua fase gassosa, in quanto ogni molecola di acqua libera reagirebbe violentemente formando una soluzione di acido fluoridrico, inoltre è ovvio che un ipotetico scenario planetario qualsiasi contiene quasi sicuramente silicati che reagirebbero per formare composti inerti come i fluoruri di silicio, impedendo quindi la sua concentrazioni in grandi quantità. Come se ciò non bastasse l’abbondanza cosmica del fluoro è molto bassa e la sua propensione a formare rapidamente composti chimicamente inerti nelle nebulose interstellari, in quanto è l’elemento più reattivo di tutti, limita fortemente qualsiasi ipotesi di biochimica su esso basata, non escludendo del tutto rare nicchie di possibili fluoro-organismi.
Non solo carbonio

Una fusione mentale tra due forme di vita antitetiche, un Vulcaniano e un Horta
L’unicità del carbonio risiede proprio nell’ingombro contenuto e nel ridotto numero di elettroni esterni che gli conferiscono la massima possibilità di formazione di legami, singoli, doppi, tripli, con se stesso e con chi può condividere l’ottetto. I legami multipli del carbonio sembrano ineguagliabili, almeno nelle condizioni ambientali simil-terrestri, un atomo di silicio ad esempio, al massimo potrà formare silani (l’equivalente degli alcani per il carbonio), ma non riesce a formare sileni e silini. Inoltre, pensiamo al fatto che la silice (SiO2), corrispondente alla CO2, si trova allo stato solido, mentre i suoi composti con l’idrogeno sono altamente reattivi.
Ciò tuttavia non esclude altre possibilità: ad esempio si potrebbe ipotizzare una biochimica dell’azoto, magari favorito da un ambiente ammoniacale come già visto, in più anch’esso forma numerosi composti relativamente stabili con idrogeno e ossigeno, e magari insieme al fosforo potrebbe fare a meno dell’ausilio del carbonio!
Anche cloro, boro e zolfo potrebbero competere o partecipare nella formazione di macromolecole molto complesse, se poi mettiamo in conto che estremizzando pressioni e temperature difficilmente possiamo prevederne i meccanismi, allora le possibilità diventano esponenziali nella loro casualità (e causalità)…
La chimica del boro ad esempio, si è rivelata molto più complessa di quanto inizialmente si è pensato. Di recente infatti è stato osservato che l’esclusivo club degli elementi chimici capaci di legarsi insieme con un triplo legame stabile (comprendente carbonio e azoto) ha accettato un nuovo membro. Le teorie hanno previsto che tali strutture del boro potevano essere reali, dopotutto tripli legami azoto-azoto e carbonio-carbonio sono stabili come dimostra l’azoto atmosferico, o il gran numero di molecole contenenti carbonio ibridato sp. Sappiamo che il boro ha la capacità di formare cluster poliedrici e legami a tre centri e due elettroni, in cui tre atomi sono legati unicamente da un orbitale molecolare localizzato su questi tre atomi, contenente due elettroni in modo da produrre molecole molto più stabili di quelle organiche dello stesso tipo, come quelle dei passaggi intermedi delle transizioni dei carbocationi. Anche qui tuttavia riscontriamo l’ostacolo della sua scarsa abbondanza che pregiudica alquanto lo sviluppo di una vita su di esso basata.

Replicanti di Stargate SG1, quando il silicio diventa micidiale
La chimica del silicio meriterebbe un corposo capitolo esclusivamente dedicato in quanto è l’alternativa di elezione quando si tratta di speculare su forme di vita non basate sul carbonio, già dalla fine del XIX secolo infatti l’astrofisico tedesco Julius Scheiner, probabilmente il primo a pensarci concretamente, si rese conto del fatto che la stabilità al calore dei composti del silicio potrebbero consentire l’esistenza di vita ben oltre la gamma di temperature a cui siamo abituati, grazie alle dichiarazioni del chimico inglese James Emerson Reynolds. Nel 1894 H. G. Wells su questa base, immagina organismi di alluminio e silicio che errano attraverso un’atmosfera di zolfo gassoso sulle spiagge di un mare di ferro liquido, migliaia di gradi al di sopra della temperatura di una fornace ardente. Trent’anni dopo è sempre Haldane che certifica la possibilità di una vita sbocciata nelle profondità di un pianeta contenente silicati fusi, con forniture energetiche basate sull’ossidazione del ferro.
A prima vista il silicio sembrerebbe un ottimo candidato in alternativa al carbonio: è molto comune nell’universo ed è uno degli elementi che appartengono allo stesso gruppo del carbonio, conservando un peso atomico limitato e molte similitudini sulla reattività e sulle proprietà dei suoi composti, entro certi canoni. Anche il silicio forma lunghe catene di polimeri, alternandosi eventualmente con l’ossigeno per formare in analogia con i poliacetali, altri scheletri altrettanto robusti noti come siliconi o polisilossani.

Un pilota toliano che sopravvive a temperature e pressioni estreme
Una forma di vita basata sul silicio potrebbe tranquillamente dipendere dall’ossigeno per mezzo di una particolare respirazione che emette biossido di silicio, il quale si organizza in un lattice in cui gli atomi di silicio sono circondati da quattro atomi di ossigeno. Un altro dogma che di recente è stato spezzato è la presunta assenza di chiralità da parte dei composti del silicio, che poteva limitare un qualsiasi sistema enzimatico basato sull’orientamento degli enantiomeri in gioco. Da qualche anno infatti sono diventate comuni sperimentazioni di laboratorio che trattano reagenti di silicio chirale. Esiste addirittura un ipotesi che spiegherebbe il problema dell’omochiralità (un mistero magistralmente illustrato da Popinga). In poche parole è quantomeno singolare che i carboidrati si trovino preferenzialmente nella forma destrogira e gli aminoacidi in quella levogira. L’ipotesi sarebbe che i primi composti prebiotici di carbonio si sono formati in una pozzanghera di brodo primordiale situato su una superficie di silicio avente una certa configurazione non sovrapponibile. Questa protochiralità potrebbe aver determinato un favoritismo nei confronti di un’eventuale miscela racemica, per isolare solo un tipo di enantiomero, quasi un esempio ante-litteram di selezione naturale!
Nella fantascienza sono numerosi gli esempi di forme di vita basata sul silicio, comprendenti anche i casi che definiamo vita artificiale, tra i quali spicca la mitica Horta: una creatura dell’universo di Star Trek composta da un materiale simile all’amianto fibroso che si sposta secernendo un acido altamente corrosivo che consente di attraversare la roccia come noi attraversiamo l’aria. La specie degli Horta (se paragonata alle forme di vita basate sul carbonio) possiede un ciclo vitale insolitamente lungo. Ogni 50.000 anni tutti gli Horta muoiono eccetto uno, chiamato Horta madre, che sorveglia le uova finché non si schiudono, quindi fa da madre ai piccoli e li protegge. Immaginate cosa significhi minacciare la generazione successiva per una madre che ha covato per tutto questo tempo le proprie uova e capirete quanto possa risultare azzardato un tale comportamento!
Il cosiddetto sciovinismo del carbonio, il quale presuppone sistemi e processi chimici basati principalmente sull’elemento numero sei della tavola periodica a causa della supremazia delle proprietà termodinamiche che lo rendono superiore a tutti gli altri elementi, può quindi essere contrastato agevolmente tramite sentieri ancora inesplorati della chimica, dove non manchino complessità, sistemi solvente adeguati alle condizioni ambientali e abbondanza di materia prima altrimenti esotica, per assemblare un sistema biologico alternativo e funzionale. Implicito è anche lo sforzo richiesto per estendere il concetto di forma di vita, per il quale anche lo sciovinismo molecolare diventerebbe superato. Chiudo quotando l’astrofisico Victor J. Stenger, in un universo con proprietà differenti, i nuclei atomici o altre strutture potrebbero assemblarsi in modi decisamente poco familiari, e aggiungerei che ciò non è affatto una eventualità da sottovalutare.
Fonti:

Sagan, C.; Salpeter, E. E. (1976). Particles, environments, and possible ecologies in the Jovian atmosphere Astrophysical Journal Supplement Series DOI: 10.1086/190414
James Mitchell Crow (2012). Boron finally gets a triple bond Nature DOI: 10.1038/nature.2012.10836