 Dopo la precarizzazione delle costanti di decadimento radioattivo e il recente assedio alla costante di struttura fine alfa, adesso è arrivato il turno dei pesi atomici, il momento è storico: è giunta la proposta di revisione per i valori convenzionali delle masse di alcuni elementi chimici, ovvero le medie ponderate delle masse relative dei suoi isotopi in funzione della loro relativa abbondanza, al fine di ottenere una maggiore precisione in risposta alle attuali e accresciute conoscenze grazie alle più recenti innovazioni delle tecnologie di misura.
Dopo la precarizzazione delle costanti di decadimento radioattivo e il recente assedio alla costante di struttura fine alfa, adesso è arrivato il turno dei pesi atomici, il momento è storico: è giunta la proposta di revisione per i valori convenzionali delle masse di alcuni elementi chimici, ovvero le medie ponderate delle masse relative dei suoi isotopi in funzione della loro relativa abbondanza, al fine di ottenere una maggiore precisione in risposta alle attuali e accresciute conoscenze grazie alle più recenti innovazioni delle tecnologie di misura.
 In fondo, pensandoci bene, la tavola periodica degli elementi è sempre stata in perenne evoluzione, non mancano di certo le (circa-periodiche) aggiunte di nuovi atomi “sintetici”, oramai abbiamo raggiunto il 118° elemento, completando così anche il settimo periodo. I nuovi arrivi sono tutti battezzati inizialmente con un nome standardizzato costruito con un criterio greco-numerico, come ad esempio l’ununoctio, e solo a seguito delle prime conferme, verranno ridenominati con quello che sarà il nome definitivo, con il benestare della IUPAC .
In fondo, pensandoci bene, la tavola periodica degli elementi è sempre stata in perenne evoluzione, non mancano di certo le (circa-periodiche) aggiunte di nuovi atomi “sintetici”, oramai abbiamo raggiunto il 118° elemento, completando così anche il settimo periodo. I nuovi arrivi sono tutti battezzati inizialmente con un nome standardizzato costruito con un criterio greco-numerico, come ad esempio l’ununoctio, e solo a seguito delle prime conferme, verranno ridenominati con quello che sarà il nome definitivo, con il benestare della IUPAC .
In attesa della conferma ufficiale delle modifiche, evidenziate e circostanziate in un rapporto rilasciato da poco (anche se datato 2009), le nuove tavole periodiche dovranno riportare il peso atomico di ben dieci elementi, non più con il solito numero adimensionale che ben conosciamo, bensì questo sarà indicato con un intervallo, piuttosto inquietante, a prima vista. Gli elementi in questione sono idrogeno, litio, boro, carbonio, azoto, ossigeno, silicio, zolfo, cloro e tallio, stiamo quindi parlando di elementi chimici di primo piano.
Diciamo subito che i “vecchi” pesi atomici andranno ancora benissimo per i normali calcoli scolastici, in questi casi non c’è nulla da preoccuparsi. Tuttavia, queste piccole variazioni rivestono un’importante differenza nella ricerca scientifica e nel relativo sviluppo applicato all’industria. Per esempio, la misura precisa dell’abbondanza degli isotopi del carbonio, può trovare impiego nella determinazione della genuinità o della provenienza delle derrate alimentari.

Il dottor Michael Wieser ImageCredit: Riley Brandt/University of Calgary via PhysOrg
La misurazione degli isotopi di azoto, cloro e altri elementi viene sfruttata per tracciare sostanze inquinanti nelle falde e nelle acque superficiali. Anche in ambito forense, nella lotta al doping sportivo, è possibile identificare le molecole di testosterone sintetico per discriminarlo con certezza da quello di origine umana, poiché il peso atomico del carbonio naturale nell’ormone è maggiore di quello artificiale contenuto in un farmaco.
Il dottor Michael Wieser, professore all’Università di Calgary e segretario della Commissione per l’abbondanza isotopica e il peso atomico della IUPAC, sostiene:
Per più di un secolo e mezzo, si è sempre pensato di usare i pesi atomici standard – un valore singolo – che si trova all’interno delle copertine dei libri di testo di chimica e sulla tavole periodiche degli elementi. Grazie allo sviluppo tecnologico, abbiamo scoperto che i numeri presenti sulle nostre tabelle non sono poi così statici come abbiamo pensato finora.
Il peso atomico di questi dieci elementi verrà quindi espresso come un intervallo, con un limite inferiore e uno superiore, così da riflettere con più accuratezza la variabilità riscontrata sperimentalmente in un gran numero di ricerche dedicate, condotte tra il 1985 e il 2010.
Per esempio, lo zolfo ha un peso atomico standard di 32,065. Tuttavia, il suo reale peso atomico può variare da 32,059 a 32,076, a seconda della fonte originaria dell’elemento.
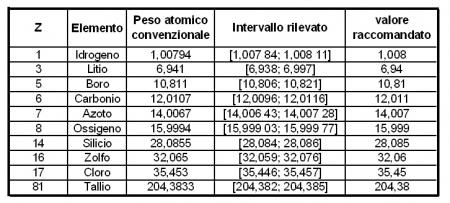
Confronto tra pesi atomici standard, intervalli e valori raccomandati
Nella tabella sopra, per una migliore comprensione delle variazioni, ho riunito i pesi atomici convenzionali utilizzati fino ad oggi e gli intervalli rilevati che li sostituiranno. L’ultima colonna invece riporta i valori raccomandati da utilizzare quando si rende necessario l’impiego di un valore semplice e univoco.
Dall’analisi sommaria di questa tabella, spiccano il valore decisamente asimmetrico del litio, che estende il suo limite superiore ben più in là di quello inferiore, mentre gli altri corrispondono quasi sempre al valore mediano dell’intervallo relativo.
Per converso, elementi con un solo isotopo stabile, non mostrano variazioni di rilievo nel computo del loro peso atomico. Infatti i pesi atomici standard per fluoro, alluminio, sodio e oro sono costanti, ed i loro valori sono noti fino alla sesta cifra decimale.

Fabienne Meyers. ImageCredit: IUPAC
Secondo Fabienne Meyers, al contrario di quanto si possa pensare inizialmente, gli intervalli non sono da ritenersi come una complicazione, ma nei calcoli più accurati possono rappresentare l’opportunità di stimare l’incertezza, o l’errore statistico delle misure, avvalorando i concetti fondamentali di qualità della misura e dei risultati del mondo reale, che difficilmente possono avvalersi di misurazioni assolute.
L’augurio di Micheal Wieser e Tyler B. Coplen, gli autori del rapporto tecnico, è che i chimici e gli educatori prendano questa sfida come un’opportunità per incoraggiare l’interesse dei giovani per la chimica e stimolare un certo entusiasmo per il futuro creativo della chimica, una disciplina in cui c’è davvero molto da fare.
E che a nessuno venga in mente di pensare che queste sono variazioni talmente irrisorie da essere trascurabili. Provate a cambiare la 5° cifra decimale del pi greco sotto il naso di un matematico, vedrete con che velocità vi ritroverete a comprendere le fattoriali ripercussioni sui volumi delle sfere!
Fonti: Rapporto tecnico IUPAC, comunicato stampa U. Calgary, Physorg
Wieser, M., & Coplen, T. (2010). Atomic weights of the elements 2009 (IUPAC Technical Report) Pure and Applied Chemistry DOI: 10.1351/PAC-REP-10-09-14