L'obesità e il diabete di tipo 2 sono caratterizzate da alterato microbiota intestinale, infiammazione, e la rottura della barriera intestinale. La composizione microbica e dei meccanismi di interazione che influenzano la funzione di barriera intestinale durante l'obesità e il diabete di tipo 2 non sono state chiarite. Recentemente è stato isolato akkermansia muciniphila
 , un batterio mucina-degradante che risiede nello strato di muco. La presenza di questo batterio è inversamente correlata con il peso corporeo nei roditori e nell'uomo. Tuttavia, i precisi ruoli fisiologici interpretati da questo batterio durante l'obesità e i disturbi metabolici sono sconosciuti. Uno studio ha dimostrato che l'abbondanza di A. muciniphila è diminuita negli obesi e topi diabetici di tipo 2. E’ stato anche osservato che l'alimentazione prebiotica normalizza l’abbondanza di A. muciniphila, che si correla con una migliore profilo metabolico. In condizione indirizzate, è stato dimostrato che il trattamento con A. muciniphila inverte l’alto contenuto di grassi, i disturbi metabolici dieta-indotta, tra cui l'aumento di massa-grassa, endotoxemia metabolica, infiammazione del tessuto adiposo e l'insulino-resistenza. Somministrazione di A. muciniphilaaumenta i livelli intestinali degli endocannabinoidi che controllano l'infiammazione, la barriera intestinale, e la secrezione del peptide intestinale. E’ stato anche dimostrato che tutti questi effetti obbligatori sono praticabili con A. muciniphilaperché il trattamento con calore delle cellule batteriche uccise non ha migliorato il profilo metabolico e lo spessore dello strato di muco. In sintesi, studi forniscono una notevole comprensione dei complessi meccanismi di batteri (ad esempio, A. muciniphila) che disciplinano gli incroci con la flora intestinale. I risultati forniscono anche un indirizzo razionale per lo sviluppo di un trattamento che utilizza questo colonizzatore del muco umano per la prevenzione o trattamento dell'obesità e dei suoi disturbi metabolici associati.
, un batterio mucina-degradante che risiede nello strato di muco. La presenza di questo batterio è inversamente correlata con il peso corporeo nei roditori e nell'uomo. Tuttavia, i precisi ruoli fisiologici interpretati da questo batterio durante l'obesità e i disturbi metabolici sono sconosciuti. Uno studio ha dimostrato che l'abbondanza di A. muciniphila è diminuita negli obesi e topi diabetici di tipo 2. E’ stato anche osservato che l'alimentazione prebiotica normalizza l’abbondanza di A. muciniphila, che si correla con una migliore profilo metabolico. In condizione indirizzate, è stato dimostrato che il trattamento con A. muciniphila inverte l’alto contenuto di grassi, i disturbi metabolici dieta-indotta, tra cui l'aumento di massa-grassa, endotoxemia metabolica, infiammazione del tessuto adiposo e l'insulino-resistenza. Somministrazione di A. muciniphilaaumenta i livelli intestinali degli endocannabinoidi che controllano l'infiammazione, la barriera intestinale, e la secrezione del peptide intestinale. E’ stato anche dimostrato che tutti questi effetti obbligatori sono praticabili con A. muciniphilaperché il trattamento con calore delle cellule batteriche uccise non ha migliorato il profilo metabolico e lo spessore dello strato di muco. In sintesi, studi forniscono una notevole comprensione dei complessi meccanismi di batteri (ad esempio, A. muciniphila) che disciplinano gli incroci con la flora intestinale. I risultati forniscono anche un indirizzo razionale per lo sviluppo di un trattamento che utilizza questo colonizzatore del muco umano per la prevenzione o trattamento dell'obesità e dei suoi disturbi metabolici associati.Permeabilità intestinale I peptidi antimicrobici microbiota UT, talvolta erano caratterizzati come spettatori nel tratto intestinale, ma il loro ruolo attivo nella fisiologia intestinale è ora ampiamente studiato. In particolare, il mutualismo che esiste tra la flora intestinale e l'ospite ha ricevuto molta attenzione. L'obesità e il diabete di tipo 2 sono caratterizzati da alterato microbiota intestinale, infiammazione e rottura della barriera intestinale E’ stato recentemente dimostrato un’associazione di obesità e diabete di tipo 2 con aumento della permeabilità intestinale, che induce endotossemia metabolica e infiammazione metabolica. Inequivocabili evidenze dimostrano che la flora intestinale influenza tutto il corpo . Il metabolismo influenza il bilancio energetico, permeabilità intestinale, siero lipopolisaccaridi [cioè, endotossemia metabolica], e infiammazione metaboliche associate con l'obesità e disturbi associati. Tuttavia, la composizione microbica e gli esatti meccanismi d’interazione tra questi due partner che influenzano la funzione di barriera ospite-intestino e il metabolismo rimangono poco chiari. L'epitelio intestinale è l'interfaccia per l'interazione tra la flora intestinale e i tessuti dell'ospite. Questa barriera è dispersa dalla presenza di uno strato di muco e fattori immunitari prodotte dal conduttore. Peptidi antimicrobici per l'immunità innata sono prodotte dalle cellule Paneth (ad esempio, α-defensine, lisozima C, fosfolipasi, e C-tipo lectina, soprattutto rigenerante islet-derivato 3-gamma, Reg IIIγ) o enterociti (Reg IIIγ). Effettori adattativi del sistema immunitario sono secreti nella penetrazione batterica del lume intestinale, come IgA, che può anche limitare il muco nell’ospite e il tessuto mucoso. Questi fattori immunitari consentono all'ospite di controllare le sue interazioni con flora intestinale e la forma delle sue comunità microbiche .Il sistema endocannabinoide è stato anche coinvolto nel controllo della barriera intestinale e nell’. Uno dei lipidi in questo sistema,( 2-arachidonoilglicerolo o 2-AG), riduce l' endotoxemia metabolica e l' infiammazione sistemica. Un'altro acylglycerol, (2- palmitoylglycerol o 2-PG), potenzia gli effetti antinfiammatori di 2-AG . È importante porre l’accento che, (2 oleoylglycerol o 2-OG) stimola il rilascio di peptidi intestinali, come il glucagone-come peptide-1 (GLP-1) e glucagone-come peptide-2 (GLP-2), da L-cellule intestinali. Questi peptidi sono implicati , rispettivamente, nel controllo dell'omeostasi del glucosio e la funzione di barriera intestinale. Akkermansia Muciniphila
Akkermansia Muciniphila
è stato identificata come un batterio mucina-degradante che risiede nello strato di muco: è il batterio umano dominante che colonizza abbondantemente quest’ambiente ricco di sostanze nutritive. A. muciniphila può rappresentare il 3-5% della comunità microbica in soggetti sani, e la sua abbondanza correla inversamente con il peso corporeo e il diabete di tipo 1 nei topi e nell'uomo, anche se un recente studio metagenomico ha scoperto che alcuni dei geni appartenenti ad A. muciniphila sono stati arricchiti in soggetti diabetici di tipo 2 .E’ stato recentemente scoperto che la somministrazione di prebiotici (come Oligofruttosio) a topi geneticamente obesi aumenta la abbondanza di A. muciniphila da ~100 volte . Tuttavia, le implicazioni dirette di A. muciniphila per l'obesità e il diabete di tipo 2 non sono stati determinati e i precisi ruoli fisiologici che essa svolge nel corso di questi processi non sono del tutto noti. Risultati precedenti e la vicinanza di questo batterio all'epitelio intestinale umano sostengono l'ipotesi che A. muciniphila svolga un ruolo cruciale nel mutualismo tra la flora intestinale e di accoglienza, controllando la funzione barriera intestinale e altre funzioni fisiologiche e omeostatiche durante l'obesità e il diabete di tipo 2. A. muciniphila, è stato somministrato vivo o ucciso al calore, ai topi alimentati con una dieta ricca di grassi e si è indagato sulla barriera intestinale, l'omeostasi del glucosio, e il metabolismo del tessuto adiposo per verificare questa ipotesi.A. muciniphila abbondanza o diminuzione nei topi obesi o colpiti dal diabete di tipo 2 . E’ stato osservato che l'abbondanza di A. muciniphila era 3.300 volte inferiore nei topi obesi leptina-deficiente che nelle loro masse magre . E’ stato anche osservato una diminuzione di 100 volte di questo batterio in topi -fed high-grasso- (HF).Il trattamento prebiotico ha restaurato livelli basali di A. muciniphila migliorando sia l’ endotossemia metabolica che i disturbi associati con HF-Diet-Inducente obesità correlate. I prebiotici (oligofruttosio) rimemorizzano completamente i conteggi di A. muciniphila in entrambi i modelli , sostenendo quindi i dati ottenuti da un precedente studio eseguito in topi ob / ob . La somministrazione di prebiotici in topi HF-fed, ha abolito l’endotossemia metabolica, normalizzando la sottopopolazione CD11c dei macrofagi in ADI posa di tessuto, cioè la frazione principale di aumento della ADI posa macrofagi tissutali nell'obesità . La somministrazione di prebiotici ha anche ridotto la massa grassa totale, la massa dei diversi cuscinetti adiposi (cioè, sc, mesenterica, e dell'epididimo), e il peso corporeo . Questi risultati sono segnali significativamente e inversamente correlati con abbondanza di A. muciniphila. Tuttavia, il ruolo della mancanza di A. muciniphila nei meccanismi molecolari che sottintendono alla varia insorgenza di questi disturbi non è stato dimostrato, e anche se una maggiore abbondanza di A. muciniphila inverte questi disturbi va ancora analizzata. A. muciniphila è stato somministrato per via orale per controllare o topi HF-alimentati per 4 settimane per rispondere a queste domande.Dieta HF altera la composizione della flora intestinale, considerando che A. muciniphila non è fondamentale nell’indurre significativi cambiamenti. Trattamento con A. muciniphila è stato associato ad un aumento di A. muciniphila e la sua abbondanza nel contenuto cecale di topi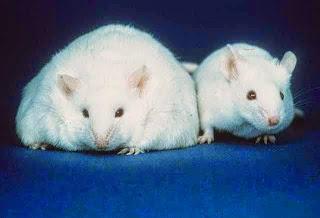
Topi obesi
.Una dieta HF cambia significativamente la flora intestinale, come mostrato dalle analisi delle componenti principali, mentre il trattamento A. muciniphila non modifica questo profilo . A. muciniphila migliora disordini metabolici in topi obesi indotta dalla dieta. Trattamento con A. muciniphila normalizza la dieta-indotta, l’endotoxemia metabolica, l'adiposità, e il marcatore del tessuto adiposo CD11c . Analogamente il peso corporeo, mediante trattamento A. muciniphila si riduce e migliora la composizione corporea (cioè, la massa grassa/rapporto massa magra) , senza variazioni di assunzione di cibo. Dimostrato anche che il trattamento con A. muciniphila rovescia completamente l’iperglicemia dalla dieta digiuno indotta, attraverso un meccanismo associato, con una riduzione del 40% nell’ espressione di glucosio-6-fosfatasi epatico, implicando anche una riduzione della gluconeogenesi. In particolare, l'indice di resistenza all'insulina è stata analogamente ridotto dopo trattamento A. muciniphila: risultati che suggeriscono un ruolo chiave per la A. muciniphila in funzione di barriera intestinale, infiammazione metabolica, e deposito di grasso. Pertanto, si ipotizza che A. muciniphila avrebbe un impatto sul metabolismo del tessuto adiposo. Dimostrato inoltre che trattamento con A. muciniphila sotto una dieta HF aumenta l'espressione di mRNA marcatori di differenziazione degli adipociti e l'ossidazione dei lipidi , senza influire sui marcatori della lipogenesi (ad esempio, l'acetil-CoA carbossilasi): dati che confermano l’ ipotesi che A. muciniphila controlla il deposito di grasso, il metabolismo del tessuto adiposo e, l'omeostasi del glucosio.Trattamento con A. muciniphila esercita effetti minori sui peptidi antibatterici contenuti nei livelli di ileo e dell’IgA con le feci. La mucosa intestinale contribuisce al mantenimento della barriera intestinale secernendo peptidi antimicrobici per l'immunità innata:sono prodotti dalle cellule Paneth (ad esempio, α-defensine, lisozima C, fosfolipasi, e C-tipo lectina, in primo luogo la RegIIIγ) o enterociti (RegIIIγ) . E’ stata misurata l'espressione di Paneth e i marcatori antibatterici nelle cellule epiteliali nell'ileo per chiarire l'impatto della dieta HF e del trattamento A. muciniphila sulla funzione barriera intestinale. L’abbondanza di A. muciniphila diminuisce, in topi obesi e diabetici e il trattamento prebiotico restaura A. muciniphila a livelli basali, invertendo, l’endotossemia metabolica e disturbi correlati. Massa totale di grassi guadagno misurata via NMR nel dominio del tempo (n = 10). (A. muciniphila contrasta l’endotoxemia metabolica, l'obesità indotta dalla dieta, l’infiltrazione dei macrofagi nel tessuto adiposo, migliora l’omeostasi del glucosio e il metabolismo del tessuto adiposo, tutti fattori indotti dalla dieta nei topi obesi senza modificare la composizione flora intestinale. Si è misurata IgA in campioni fecali come fattore adattivo del sistema immunitario. Livelli di IgA fecali non vengono colpiti dai trattamenti , suggerendo perciò che A. muciniphila controlla la funzione di barriera nell’intestino con altri meccanismi di segnalazione epiteliale .A. muciniphila comporta l’aumento di endocannabinoide (acilgliceroli) contenuto nell'ileo: è stato osservato un legame tra flora intestinale e il tono endocannabinoide nel sistema intestinale. Dimostrato in precedenza un collegamento diretto tra acilgliceroli e la funzione barriera intestinale. Pertanto, misurati i livelli acylglycerol intestinali si dimostra che il trattamento A. muciniphila aumenta i livelli di 2-OG, 2-AG, e 2-PG, con risultati che supportano un collegamento diretto tra la somministrazione di A. muciniphila e livelli intestinali di acilgliceroli, coinvolti nell’omeostasi del glucosio e in quella intestinale.A. muciniphila neutralizza, la barriera mucosa eretta nel colon, dalla dieta indotta, durante l'obesità. Le interazioni tra il microbiota intestinale e lo strato di muco sono sistemi dinamici che influenzano il muco come barriera biologica: si è studiato allora l'impatto del trattamento A. muciniphila dallo spessore dello strato di muco interno. Si è dimostrato un 46% diluenti strato di muco nei topi HF-fed, e il trattamento A. muciniphila contrastava questa diminuzione. A. muciniphila valido ma termicamente ucciso, contrasta la barriera eretta dalla mucosa dalla dieta metabolica indotta e durante l'obesità. Per ulteriormente dimostrare se A. muciniphila deve essere vivo per esercitare i suoi effetti metabolici, si è confrontato l'impatto generato dalla somministrazione di A. muciniphila vivo, con quello di A. muciniphila, ucciso dal calore. Si è scoperto che la somministrazione di A. muciniphila vivo contrasta l’endotossemia indotta dalla dieta metabolica, lo sviluppo della massa grassa, e l’alterata posa del metabolismo,nel tessuto ADI in misura simile a quanto osservato nel primo set di esperimenti . Va sottolineato che questi effetti non sono stati osservati dopo la somministrazione di A. muciniphila ,ucciso dal calore. Inoltre, si è trovato che A. muciniphila vivo e vitale ha ridotto significativamente i livelli di glucosio plasmatico, dopo un test di tolleranza al glucosio per via orale, mentre A. muciniphila ,ucciso dal calore, ha evidenziato un intolleranza al glucosio simile a quella dei topi alimentati HF. A. muciniphilia vitale, sviluppa la colonizzazione di A. muciniphila con funzione di restaurata barriera intestinale e degli endocannabinoidi intestinali, sgualciti nei topi obesi da dieta-indotta.L'obesità indotta dalla dieta HF è associabile a cambiamenti nella composizione flora intestinale . Tuttavia, i peptidi antimicrobici in ileo non sono influenzati dai trattamenti. Al contrario, l'espressione Reg3g nelle cellule epiteliali del colon era significativamente ridotta, di circa il 50%, in topi HF e trattati con A. muciniphila, ucciso dal calore, mentre il trattamento con A. muciniphila vitale completamente smussa questo effetto e determina una maggiore espressione Reg3g su dieta HF, nella drammatica diminuzione di A. muciniphila in topi obesi geneticamente e indotti dalla dieta. Il trattamento prebiotico (oligofruttosio) ha restaurato in abbondanza A. muciniphila, creando una migliore barriera intestinale e migliorato i parametri metabolici. Tuttavia, i meccanismi responsabili per la fioritura di A. muciniphila causata dalla somministrazione del prebiotico non sono chiari. A. muciniphila non cresce su supporti di oligofruttosio arricchiti (in vitro), quindi vi sono interazioni da incroci complessi di alimentazione, che contribuiscono in tal senso. Tuttavia, la somministrazione in ratti di oligofruttosio aumenta il numero di cellule caliciformi e lo spessore dello strato di muco . Così, se l'alimentazione oligofruttosio aumenta A. muciniphila fornendo la principale fonte di energia per questo batterio e, se favorisce la sua crescita o se l'incremento di A. muciniphila aumenta la produzione di muco e la sua degradazione, restano ancora da dimostrare. Non si può escludere che oligofruttosio induce specifici cambiamenti nei batteri intestinali e incroci di alimentazione promuovono la crescita di A. muciniphila. Qual è l'impatto diretto di A. muciniphila? Si è invertito il fenotipo patologico ripristinando l'abbondanza fisiologica di questo ceppo di topi obesi e diabetici e si dimostra il ruolo chiave di A. muciniphila nella fisiopatologia di obesità, diabete di tipo 2, e in infiammazioni metaboliche. A. muciniphila vitale, controlla la funzione intestinale di barriera, la memoria di massa grassa, e l'omeostasi del glucosio negli obesi e in topi diabetici di tipo 2 attraverso diversi meccanismi. I principali punti deboli nelle indagini sul ruolo della flora intestinale nell'eziologia di obesità e diabete di tipo 2,vengono rilanciate sulle conclusioni che si basano su dati correlativi tra batteri (o un genere) e parametri fisiologici, perché la maggior parte dei batteri intestinali sono stati identificati a livello filogenetico (ad esempio, attraverso approcci metagenomici), ma non sono mai stati coltivati.Altri studi dimostrano l'importanza di batteri selezionati [cioè, Lactobacillus spp, Bifido bacterium spp, e Bacteroides uniformis] sullo sviluppo della massa grassa durante l'obesità indotta dalla dieta, ma gli scopi di questi studi erano puntati su altri obiettivi. Studi diversi hanno esaminato l'impatto della supplementazione con uno specifico ceppo probiotico o ceppi che sono stati isolati da bambini sani sui parametri fisiologici. E’ stato studiato il ceppo interessato durante l'obesità e il diabete di tipo 2 negli esseri umani e roditori . I probiotici sono molti meno opportuni per il contatto diretto con la mucosa, ma A. muciniphila può indurre risposta degli ospiti differenziali a causa del più intensivo contatto con la mucosa dell'ospite. Per confermare questa ipotesi, sono stati curati topi HF, alimentandoli con un probiotico, cioè, Lactobacillus plantarum WCFS1 e la sua somministrazione non cambia lo sviluppo di massa grassa, il metabolismo del tessuto adiposo, lo spessore dello strato di muco, colon Reg3g mRNA, e l’ endotossemia metabolica. Questo suggerisce che A. muciniphila induce risposte dell'ospite specifiche rispetto ad altri microbi.A. muciniphila è un batterio Gram-negativo(cioè, contiene LPS) che costituisce il 3-5% della comunità microbica intestinale. Dimostrata però, l'assenza di una relazione diretta tra l'abbondanza di batteri Gram-negativi all'interno dell'intestino e l’endotossemia metabolica (causata da siero LPS), perché la colonizzazione dell'intestino, provocata da A. muciniphila diminuisce l’endotossemia metabolica, derivante da una dieta HF. Quindi A. muciniphila regola la funzione di barriera intestinale a diversi livelli. Tuttavia, i diversi meccanismi d’interazione tra batteri e l'ospite che influenzano la funzione di barriera intestinale durante l'obesità e il diabete di tipo 2 non sono stati delucidati. L’obesità si associa con una riduzione dello spessore di muco, supportando a sua volta un successivo meccanismo di aumento della permeabilità intestinale (cioè, l’endotossemia metabolica), caratteristica tipica dell’obesità e, disturbi associati. A. muciniphila ripristina questo strato di muco, e contribuisce alla riduzione di metendotossemia , comportamento osservato durante il trattamento con A. muciniphila. A. muciniphila vitale induce questi effetti, mentre A. muciniphila, ucciso dal calore, non protegge i topi obesi da dieta indotta e disturbi associati. La presenza di A. muciniphila vitale all'interno dello strato di muco è un meccanismo fondamentale nel controllo del fatturato muco-ospite e migliora la funzione barriera intestinale. Tuttavia, non si escludono ulteriori meccanismi : l'abbondanza di A. muciniphila è associata alla più alta attività L-cellule (cioè, GLP-1 e GLP-2 secrezione) , ma i meccanismi alla base di questa relazione non sono noti. I dati suggeriscono che questo potrebbe essere un meccanismo chiave attraverso il quale A. muciniphila controlla la funzione di barriera intestinale, l’endotoxemia metabolica, e il metabolismo. Inoltre la somministrazione di A. muciniphila aumenta i livelli 2-AG intestinale e il livello 2-AG maggiorato, osservato dopo trattamento con A. muciniphila, può aver contribuito alla riduzione dell’infiammazione. L’induzione di questi endocannabinoidi, dopo trattamento con A. muciniphila, costituisce l'evento molecolare che lega queste caratteristiche metaboliche e giustifica ulteriori indagini. Il ripristino della fisiologica abbondanza di A. muciniphilariduce nel corpo , lo sviluppo della massa grassa, e l’hyperglycemia a digiuno, senza influenzare l'assunzione di cibo. Una variazione di accumulo dell'energia si spiega con la normalizzazione dell’adipogenesi nel tessuto adiposo e l’ossidazione degli acidi grassi. Alti livelli circolanti di LPS inibiscono la differenziazione del tessuto adiposo e la lipogenesi, contribuendo in tal modo al metabolismo del tessuto adiposo alterato, che caratterizza l'obesità . A. muciniphila ripristina la funzione di barriera intestinale e contribuisce a normalizzare la metaendotossemia metabolica e il metabolismo del tessuto adiposo. A. muciniphila induce una migliore tolleranza al glucosio e la riduzione della produzione epatica di glucosio endogeno.