Nella vita e anche nella scienza, tendiamo spesso a semplificare la nostra visione del mondo, dividendolo in bello e brutto, buono e cattivo, bianco e nero.Le semplificazioni non sono sempre da buttare e, in questo articolo, ne faremo largo uso. Abbiamo visto in un articolo precedente come le molecole (e le sostanze a cui corrispondono) possano essere classificate in due categorie: quelle che hanno un po’ più di carica positiva da una parte e un po’ più di negativa dall’altra (sostanze polari, tipo l’acqua) e quelle che invece hanno una distribuzione di carica uniforme (sostanze a polari, tipo gas e grassi). Le prime possono essere viste come calamite che si legano tra loro unendo i poli opposti, come fanno le molecole d’acqua in un bicchier d’acqua ad esempio. Le sostanze apolari possiamo invece immaginarle come palle di gomma che si muovono liberamente senza interagire tra loro (come le molecole d’ossigeno nell’aria) oppure come spaghetti che si attorcigliano tra loro (come le molecole di olio o di grasso).
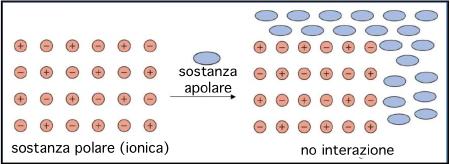
Una sostanza polare come l’acqua oppure ionica (sostanza molto polare), come il sale non interagisce (non si mescola, non si scioglie) con una apolare, come l’olio
Se mettiamo insieme calamite e palline oppure calamite e spaghetti, accade che calamite e spaghetti (o palline) se ne stanno tra loro, senza mischiarsi. Le calamite non interagiscono con le palline (o gli spaghetti) che non hanno poli carichi e quindi non hanno alcun “interesse” a separarsi le une dalle altre per andarsi a legare con palline o spaghetti. E’ quello che accade unendo acqua e olio ad esempio: l’acqua sta sotto e l’olio sopra, ognuno per i fatti suoi senza interagire.
Se invece mettiamo insieme due sostanze polari diverse, ossia calamite di tipo diverso, ma pur sempre calamite, allora queste interagiscono tra loro, come per esempio acqua e alcool (che si mescolano) o sale e acqua (l’uno si scioglie nell’altra). In altre parole “le calamite-acqua” possono separarsi le une dalle altre ed unirsi alle “calamite-alcol” o alle “calamite-sale” perché sempre di calamite si tratta! Dire “interagire”, significa anche “mescolarsi” e “sciogliersi”. Diciamo infatti: “l’olio e l’acqua non si mescolano” oppure invece “il sale si scioglie nell’acqua”, perché in questo caso le molecole di sale (sostanza ionica che significa molto polare) interagiscono con quelle di acqua. Ricapitoliamo: abbiamo sostanze polari e sostanze apolari; quando una sostanza polare incontra una apolare, le due non si mescolano; quando invece incontra un’altra sostanza polare, le due sostanze possono interagire e mescolarsi.

Infatti l’olio e soprattutto i grassi, oltre che alimenti che ingeriamo, costituiscono quasi sempre ciò che genericamente chiamiamo sporco…Lo sporco sulla nostra pelle, nei vestiti, sui piatti da lavare, ecc..In particolare le macchie che si fa fatica a “mandar via” sono quasi sempre costituite da grassi. E cosa significa “mandar via”? Significa passargli sopra un po’ d’acqua ed eliminarle. Infatti, per lavare indumenti, piatti o quasi qualsiasi altra cosa, utilizziamo l’acqua, per il semplice fatto che è il liquido più comune sulla Terra. Una macchia non preoccupante è perciò una che l’acqua riesce a sciogliere, portandosela via. Ricordiamo ora cosa abbiamo detto sopra: sciogliere significa interagire e quindi una macchia che viene lavata con la sola acqua è formata da una sostanza che interagisce con l’acqua. Al contrario la macchia che ci rovina la giornata è una che non viene sciolta dalla sola acqua, ovvero una macchia costituita da una sostanza che non interagisce con l’acqua, ossia una sostanza apolare, ossia, nella maggior parte dei casi, un grasso, un olio, tipicamente presenti nei cibi.
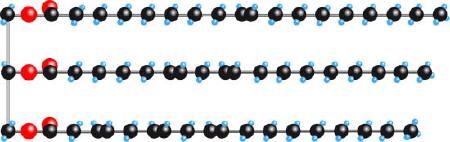
I grassi e gli oli sono miscele di molecole di questo tipo (chimicamente si tratta di un esteri): in rosso gli atomi di ossigeno, in azzurro di idrogeno e in nero di carbonio. Più specificatamente, si dicono grassi le miscele solide a temperatura ambiente e oli quelle liquide.
In particolare i grassi sono miscele di molecole caratterizzate in gran parte da lunghe catene di atomi di carbonio legati ad atomi di idrogeno (vedi figura). Queste catene sono apolari, prive cioè di zone con particolare disomogeneità di carica elettrica. Queste molecole sono gli spaghetti di cui si parlava sopra, che perciò non interagiscono con le molecole d’acqua: l’acqua sta con l’acqua, i grassi con i grassi. E la macchia sulla camicia rimane lì, nonostante gli sforzi nel bagno del ristorante…
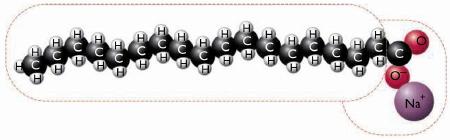
Una tipica molecola di sapone con la coda idrofoba (o lipofila) formata da atomi di idrogeno (H) e carbonio (C), e una testa idrofila polare e carica elettronicamente.
Brevissima parentesi per introdurre un semplice glossario: polare = idrofilo (che ama l’acqua) = lipofobo (che “ha paura” dei grassi); apolare = idrofobo (che “ha paura” dell’acqua) = lipofilo (che “ama” i grassi).
Ci vuole allora una sostanza, le cui molecole siano un po’ polari, come l’acqua e quindi idrofile e un po’ apolari come le macchie di sporco formate da grasso, ossia lipofile e più in particolare che abbiano una parte polare e una apolare. Questa sostanza è il sapone. Le molecole di sapone sono formate da una lunga catena apolare (lipofila) analoga a quella delle molecole di grassi che chiamiamo “coda”. E una “testa” polare (idrofila) perché carica elettricamente. E’ come se queste molecole fossero uno spaghetto a cui è agganciato una calamita. Si tratta quindi di molecole ambivalenti. Ed è proprio questa ambivalenza che consente al sapone di interagire con acqua e grasso e, in definitiva, di lavare mani, camicie e piatti.
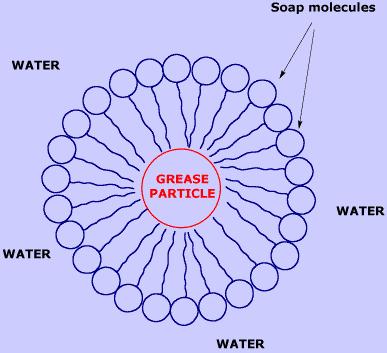
Una micella: le molecole di sapone si aggregano in maniera tale da esporre all’ambiente esterno acquoso le teste idrolife, mentre le code idrofobe (o lipofile) si dispongono verso l’interno dove può venire intrappolata una particella di grasso, anch’essa idrofoba.
Quando passiamo sullo sporco l’acqua e il sapone, le code idrofobe di quest’ultimo si allontanano dall’acqua, mentre le teste idrofile dispongono a contatto con l’acqua. Il risultato è la formazione di una struttura circolare, chiamata micella. Le particelle di grasso (“grease” nella figura) rimangono catturate all’interno delle micelle dalle code lipofile con le quali interagiscono.
A quel punto ci vuole un po’ di azione meccanica, il famoso “olio di gomito”, per staccare dai tessuti, dalla pelle o dai piatti le particelle di sporco “imprigionate” all’interno di un involucro che si scioglie in acqua. Insomma, il sapone fa da tramite tra lo sporco e l’acqua che non possono vedersi e si evitano in ogni modo. Siccome però l’acqua è la sostanza che utilizziamo per lavare, dobbiamo fare in modo che il grasso ci abbia a che fare in qualche modo. In particolare, deve potersi sciogliere nell’acqua per essere portato via. Dal momento che, di suo, non ci si scioglierebbe per niente (come l’olio con l’acqua), ecco che entra in gioco il sapone che è amico sia del grasso, sia dell’acqua: prende dentro di sé il grasso e gli dice: “Non preoccuparti grasso, vieni qui e rilassati, l’acqua non te la faccio neanche vedere, ci penso io a parlarci”. L’acqua da parte sua scioglie le micelle formate dal sapone (perché le loro “pareti” esterne sono idrofile) senza neanche rendersi conto che all’interno c’è una particella dell’odiato grasso. E il gioco è fatto!
Come ultima curiosità, sperando che non vi confonda, aggiungiamo che il sapone è ottenuto dai grassi stessi (non a caso, dato che – come visto – esiste una somiglianza tra le strutture delle molecole), facendoli reagire con una sostanza (una base come ad esempio la soda caustica) che permette di creare la testa polare (idrofila), attraverso una reazione chiamata idrolisi. In passato infatti i saponi erano preparati dal sego, un grasso di ovini e bovini che assomiglia allo strutto, che era mescolato alla lisciva (una base, ottenuta da cenere e acqua).
Da oggi in poi, lavarsi le mani sarà tutta un’altra esperienza!






