Eh sì, per me che insegno nel biennio delle superiori, questo è uno dei punti all’ordine del giorno nelle riunion per materie ( anzi di dipartimento) di inizio e resto dell’ anno: quale matematica gli studenti devono conoscere per affrontare proficuamente il corso? Quali sono i concetti da potenziare e in che modo?
Forse farei meglio a scrivere era uno dei punti all’ordine del giorno e mettere tutti i verbi al passato. Perchè? Gli studenti non hanno più difficoltà in matematica e quindi il problema non si pone? No, carissimi lettori, è che con la riforma, il problema è stato risolto alla radice, almeno per quanto riguarda quei bienni che non siano di istituto tecnico e poi anche lì….
Comunque, questo era il cuore della discussione d’inizio anno perchè, per affrontare anche a livello “che più elementare non si può” una materia scientifica, che per di più prevede parti sperimentali, è necessario sviluppare argomenti quali misure e unità di misura, notazioni scientifiche, relazioni tra grandezze, proporzioni.
Ed è proprio sull’importanza delle proporzioni in chimica che mi voglio soffermare magari scegliendo un punto di vista storico.
Catapultiamoci quindi nell’ultimo ventennio del’700 tra i grandi personaggi che con le loro idee stavano cercando di trasformare la chimica da alchimia in vera scienza.
Berlino 1790
Verso l’atomo.
L’idea di atomi come costituenti ultimi della materia si presentò spesso nel corso dei secoli senza però che su di essa si fondasse una teoria atomica chimica. La teoria corpuscolare di Boyle (1661), con la quale lo scienziato dava una spiegazionealla composizione e decomposizione delle sostanze, non ebbe riscontri sperimentali e rimase sterile ipotesi.
Solo dopo che una serie di fatti dimostrati ebbe condotto all’ idea di atomo,
solo dopo che, ammettendo questi ultimi, si potè spiegare in modo soddisfacente una serie di osservazioni,
solo allora giunse il momento di parlare della fondazione di una teoria atomica.
Prima di arrivare alla formulazione di tale teoria ( per la quale Dalton si prese gran parte del merito) doveva stabilirsi il concetto delle proporzioni chimiche, secondo le quali le sostanze semplici si riuniscono a formare composti.
Prima di Dalton, furono almeno due i chimici che iniziarono ad affrontare e a risolvere questo problema: Richter e Proust.
Agli storici risulta, infatti, che a Dalton le ricerche di Richter fossero note, inoltre, la dimostrazione di Proust delle proporzioni definite, fu da Dalton compresa nella definizione di proporzioni multiple.
Ma vediamo questo Jeremias Benjamin Richter, che dai libri di scuola non viene citato

http://en.wikipedia.org/wiki/File:Jeremias_Benjamin_Richter.jpeg
Nato a Hirschbergh(slesia) nel 1762, fu segretario delle miniere a Breslau , quindi assessore minerario, e si impiegò come arkanist (chimico) nella fabbrica di porcellana di Berlino. Morì nel 1807.
La sua ricerca prevalente fu quella della determinazione dei rapporti di peso secondo cui gli acidi si riuniscono con le basi per formare i sali e i risultati delle sue indagini comparvero tra il 1792-1794 nel suo”Anfangsgrǜnden der Stöchiometrie oder Messkunt chemischer elemente”( rudimenti di stechiometria) e nella sua opera “ Ueber die neueren Gegenstände der Chemie”, apparsa periodicamente dal 1792 al 1802, che è in gran parte continuazione del primo libro.
Altri chimici prima di lui si erano occupati dell’argomento e i particolare Wenzel ( Dresda 1740-17939) aveva posto in evidenza, attraverso l’esperimento, che la reazione tra acidi e basi avveniva secondo rapporti costanti. Partendo da qui e con suoi esperimenti, nel 1792 Richter dedusse la legge di neutralizzazione, cioè i rapporti di combinazione tra acidi e basi per dare sali neutri.
Richter, seguace non del tutto convinto della teoria del flogisto, si esprimeva in un linguaggio piuttosto oscuro, ma la sua legge suona più o meno così:
”Se una stessa quantità di un acido viene neutralizzata da quantità diverse di due o più basi, queste ultime sono equivalenti e sono neutralizzate da una quantità uguale d’un altro acido o viceversa”
Nel 1793 stabilì, quindi, che “se si mescolano due soluzioni neutre e ha luogo una reazione i nuovi prodotti che si formano son pure , quasi senza eccezione, neutri” e concluse perciò che gli elementi debbono trovarsi tra loro in un rapporto determinato di massa” In questo modo è possibile calcolare la composizione dei composti ottenuti da quella delle sostanze reagenti,
Una serie di esperimenti , da lui condotti, dimostrarono che la quantità di basi, che si combinano con un qualsiasi acido, conservano tra loro gli stessi rapporti nelle combinazioni con tutti gli altri acidi.
Nel 1797, osservò, prima di Proust, la capacità che hanno Ferro e Mercurio di combinarsi con l’ Ossigeno secondo due rapporti diversi,
In sostanza Richter scoprì che occorrevano quantità fisse e definite per le reazioni: il chimico non poteva contare su quella certa tolleranza che era concessa ai cuochi in cucina, dove una certa variazione in più o in meno di un ingrediente non riveste eccessiva importanza (Vissani mi lascerà passare questa osservazione?)
Esisteva invece un qualche cosa chiamato EQUIVALENTE ( termine coniato da Cavendish nel 1776): ovvero il peso fisso di una sostanza reagisce con il peso fisso di un’altra sostanza.
Le idee di Richter furono ignorate per lungo tempo essenzialmente per due motivi, uno reale l’altro d’opinione. Quello reale era che scriveva in modo assolutamente oscuro e incomprensibile e quindi le sue opere non ebbero una gran diffusione, l’altro … fu il suo rapporto con la matematica.
Durante la sua formazione Richter ebbe modo di ascoltare le letture di Immanuel Kant e di rimanerne profondamente impressionato. Kant( che era d’ accordo con la teoria del flogisto ) considerava come vere scienze solo la matematica e la fisica e pensava che solo una rigorosa base matematica potesse portare la chimica, allora empirica e qualitativa a livello di scienza.
Richter subì l’influenza di questo pensiero e andò oltre; giunse infatti alla convinzione che la chimica fosse una parte della matematica applicata e cercò di dimostrare l’esistenza di rapporti definiti aritmetici tra i pesi di combinazione degli acidi e delle basi. Le sue osservazioni l’avevanoinfatti portato a concludere che i pesi di combinazione degli acidi e delle basi formano serie quasi regolari: i primi serie aritmetica , i secondi geometrica. Chiamò questa legge inesistente di progressione e spese gran parte della sua attività per dimostrarla, trascurando la legge di neutralizzazione .
Si deve a Fischer il merito di aver portato alla luce le verità nascoste tra le righe oscure di Richter e la pubblicazione delle prime tavole dei pesi equivalenti, riferite come unico standard, a 1000 parti di acido solforico
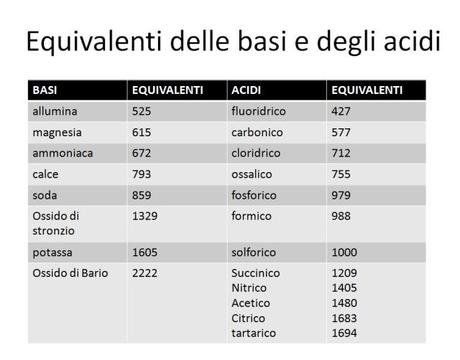
“Il significato di questa tabella – scrisse Fischer- è il seguente: se si considera una sostanza di una delle due colonne, per esmpio la potassa alla quale compete il valore 1605, i numeri dell’altra colonna indicano le quantità di ciascun acido necessarie per neutralizzarla
A proposito del’opera di Richter, Fischer fece questa arguta osservazione: “ il contenuto chimico spaventava i matematici e la veste matematica spaventava i chimici.”
Solo molto tempo dopo la sua morte , i meriti di Richter furono riconosciuti in tutto il loro valore : egli fu il fondatore della dottrina degli equivalenti. Fu anche il fondatore della stechiometria, “l’arte di misura chimica che considera le leggi secondo le quali le sostanze si riuniscono, per formare composti chimici.”
Richter stesso dice che non potè trovare un nome migliore per questa disciplina che quello di stechiometria da στόιχέϊöν, che indica qualcosa che non può scomporsi oltre μέτρεϊν, che significa trovare rapporti di grandezze.
Concludo la storia di questo scienziato con le parole di uno storico della scienza, che mi sembrano davvero appropriate:
“ La storia della nostra scienza offre pochi esempi in cui verità importanti e già dimostrate sfuggono per tanto tempo e a tal punto che, riconosciuto finalmente il merito della scoperta, esso fu attribuito in minima parte allo scopritore, e in gran parte ingiustamente a un altro.” Kopp

http://it.wikipedia.org/wiki/File:Joseph_Louis_Proust.jpeg
Ed eccoci a Proust.
Nato ad Angers nel 1755 , studiò alla scuola di Rouelle e applicò le sue conoscenze di chimica farmaceutica dapprima come direttore della farmacia al Salpetriere Hospital di Parigi,e in seguito insegnando in varie università della Spagna. Le sue migliori ricerche le condusse a Madrid nel 1791. La guerra (1808) gli tolse il posto e il laboratorio fornitissimo riducendolo in miseria. Verso la fine della sua vita fu accolto nell’ Accademia di Parigi e gli fu concessa una pensione. Morì ad Angers nel 1826.
I suoi lavori più importanti nacquero da una dotta

http://it.wikipedia.org/wiki/File:Berthollet_Claude_Louis_.jpg
disputa con un altro famoso scienziato Claude Louis Berthollet
Secondo quest’ultimo infatti era possibile che i rapporti costanti dei costituenti chimici non fossero una regola, ma che in un composto chimico risultante dall’ unione di due sostanze, “tanto maggiore era la massa di una sostanza, che doveva entrare in un composto, quanto più di essa ve ne era disponibile , a meno di circostanze speciali”
Proust intraprese la lotta contro Berthollet, confutando, in base a ricerche esatte, una ad una le conclusioni teoriche del suo oppositore. La contesa, che ebbe inizio nel 1799 si protrasse per 8 anni e finì con la prova accertata che i rapporti di combinazione erano costanti.
Nel 1799 Proust aveva già dimostrato la composizione costante del carbonato di rame naturale e artificiale. In seguito fece poi osservazioni su i due gradi di ossidazione dello stagno SnO di colore bruno contenente il 20% di ossigeno e SnO2 di colore bianco che contiene il 28% di ossigeno. Trovò anche che il rame dà due ossidi CuO, nero, col 25% di ossigeno e Cu2O rosso bruno con il 17-18% di ossigeno. Dimostrò poi che le proporzioni tra i metalli e l’ossigeno o lo zolfo erano costanti nei singoli composti spingendosi oltre e dimostrando che se due elementi si combinano secondo più rapporti, questi cambiano a salti e non gradualmente.
Di opinione opposta era Berthollet, che aveva creduto, da suoi esperimenti, di poter trarre conclusioni opposte e cioè che i metalli potessero formare ossidi aumentando gradualmente la quantità di ossigeno, ma Proust dimostrò che alla base di queste sue deduzioni, c’erano dei grossolani errori sperimentali, come quello di non aver condotto le indagini su composti definiti, ma su miscugli.
Nel 1806 poteva con sicurezza affermare:
“Un composto è un prodotto privilegiato al quale la natura ha dato una composizione costante . La natura quando, anche quando agisce attraverso l’intervento dell’uomo, non produce mai un composto altrimenti che con la bilancia nelle mani, secondo il peso e la misura. Da un polo all’altro, i composti hanno la medesima composizione. Il loro aspetto esteriore può essere differente in dipendenza della loro complessione, male loro proprietà non sono mai diverse. Non vediamo nessuna differenza tra l’ossido di ferro dell’emisfero sud e nord, il cinabro giapponese ha la stessa composizione di quello spagnolo, il clorurro d’argento è assolutamente il medesimo provenga esso dal Perù o dalla Siberia. In tutto il mondo esiste un solo cloruro di sodio, un solo salenitro, un solo solfato di calcio, un solo solfato di bario. L’analisi conferam ad ogni passo questi fatti.” ( Kapustinski- Louis proust e la scoperta della legge della composizione costante)
Proust dimostrò la validità dei rapporti di combinazione, ma non cercò di chiarirne la causa! Fu Dalton a condurre calcoli accurati sulle quantità di un elemento, che si unisce ad un altro, secondo più rapporti, riferendosi a una stessa quantità di quest’ultimo. Come risultato si ebbero le proporzioni multiple che egli seppe spiegare chiaramente con l’aiuto della ipotesi atomica.
Bene , questa è la storia, per sommi capi, dei primi burrascosi contatti fra chimica e matematica.
Si provi ora a immaginare di “pretendere” delle ricadute didattiche da questo flash storico.
Si supponga quindi di raccontare agli studenti di Richter e di Proust. Balza all’occhio che, perché ci capiscano qualcosa, deve essere presente nella loro preparazione, almeno un prerequisito, un concetto chiave : quello di proporzione .
Ci si aspetterebbe che dopo otto anni di scolarizzazione questo concetto non abbia più segreti per alunni del biennio delle superiori: non è affatto così. L’idea di proporzione è cosa talmente complicata, che solo una minuscola parte dei ragazzi può dire di averla compresa.
II punto qual è ? E’ che senza questo primo passo in chimica ci si blocca. Non c’è miscuglio, non c’è composto, non c’è concentrazione, né formula, semplicemente non c’è chimica.
Notando un clamoroso aumento di queste carenze matematiche, negli ultimi anni ho provato a sfruttare il mio asso nella manica, l’esperienza di laboratorio (insostituibile risorsa) in diversi modi. Ho provato a usarla come punto di partenza o come punto d’arrivo, come lavoro individuale o in gruppi cooperativi, ma, date le premesse, in tutti i casi , il grado di insuccesso è stato sì alto, ma pur sempre meno disastroso di una lezione frontale con copia dal vero di formule dalla lavagna, di una videoesperienza e via dicendo
Tra poco anche l’aiuto del laboratorio verrà a mancare per la scomparsa dei laboratori come tali o, in presenza degli ambienti, per assenza degli insegnanti tecnico pratici, cancellati o resi inutili dalla riforma, per mancanza delle sostanze e della strumentazione da utilizzare o troppo care o troppo pericolose (!) e così via.
E quindi?
Stando così le cose, passerò ad una chimica omeopatica in cui la parte teorica sarà diluita in proporzione 1: 1000 in acqua del rubinetto visto che quella distillata la scuola potrebbe non permettersela. E Proust? Vorrà dire che i miei studenti sapranno quello che sanno in fisica del principio di Archimede : una specie di formula magica insensata, che ripetono a memoria. Almeno provassero a cantarla!!
Quando due elementi si combinano tra loro per formare un neocomposto, le loro quantità effettivamente reagenti si combinano secondo proporzioni in massa definite e costanti. la la la, la la la.
Questo post partecipa al 29°Carnevale della Chimica ospitato dal blog Dropsea di Gianluigi Filippelli
Bibliografia
Solov’ev- L’evoluzione del pensiero chimico- Biblioteca della EST- 1976
Meyer-Giua- storia della chimica- Hoepli- 1915
Asimov- Breve storia della chimica- Zanichelli 1998






