
Image via Wikipedia
La notte di San Silvestro è appena sfumata, scandita da rimbombanti percussioni di natura pirotecnica ed enologica, in un susseguirsi di fulminee manifestazioni entropiche di materia ed energia tra formidabili pressioni gassose e ossidoriduzioni implacabili, in grado di far schizzare per metri un leggero agglomerato di sughero ormai libero dalla morsa della gabbia metallica che lo tratteneva saldamente sulla bottiglia, oppure capaci di proiettare nella profonda troposfera un artefatto alchemico portatore di un tripudio variegato con quelle fantastiche esplosioni di colori impazziti che però fanno impazzire anche gli ignari quattrozampe spaventati.
Non essendo un grande estimatore dei fuochi d’artificio, ho approfondito un aspetto forse meno effimero che di solito caratterizza le nostre feste, e che potrebbe rimanere valido e utile per tutto l’anno e anche oltre!
Quanta chimica si cela dietro quel bicchiere di prezioso liquido variabilmente paglierino e ospite immancabile sulle tavole dei festeggiamenti di tutto il mondo? Il Professor Klaus Roth dell’Institut für Chemie und Biochemie di Berlino ha esaminato a fondo la questione, e non riesco ad evitare di riportare alcune delle sue più interessanti osservazioni.
 Gli esperti sanno bene che lo spumante va servito sempre freddo, non ghiacciato, ad una temperatura ottimale compresa tra i 6° e gli 8° se è giovane, ma anche fino ai 10° quando si tratta di un prodotto maturo o millesimato. A temperature più elevate, una maggiore quantità di CO2 si disperde durante l’apertura, mentre a temperature più basse il caratteristico aroma non riesce a svilupparsi e a diffondersi con efficacia, privandoci così di gran parte del piacere olfattivo che dovrebbe sempre accompagnarlo.
Gli esperti sanno bene che lo spumante va servito sempre freddo, non ghiacciato, ad una temperatura ottimale compresa tra i 6° e gli 8° se è giovane, ma anche fino ai 10° quando si tratta di un prodotto maturo o millesimato. A temperature più elevate, una maggiore quantità di CO2 si disperde durante l’apertura, mentre a temperature più basse il caratteristico aroma non riesce a svilupparsi e a diffondersi con efficacia, privandoci così di gran parte del piacere olfattivo che dovrebbe sempre accompagnarlo.
Curiosamente, le bollicine nello spumante non possono formarsi spontaneamente se non trovano alcune condizioni favorevoli. Esse infatti richiedono una superficie affetta da impercettibili imperfezioni come può essere l’interno di un bicchiere di vetro cosparso di microscopiche rugosità, le quali consentono l’innesco grazie alle “microbolle pioniere”. Una superficie perfettamente liscia costituirebbe quindi un ostacolo insormontabile per ben apprezzare quelle armoniche file di interminabili bollicine, che allietano la vista e decretano la genuinità.
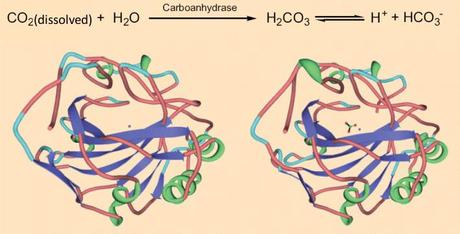 Il pregiato e durevole effetto che solletica la lingua al primo sorso, è causato solo in parte dallo scoppio delle bolle di CO2 che si riversano sulla superficie ruvida della lingua. L’effetto è coadiuvato in maniera sostanziale dal biossido di carbonio disciolto, che riesce a penetrare agilmente negli strati più profondi della mucosa linguale. In questa sede, con l’aiuto di un enzima, la carbonato deidratasi, la CO2 viene convertita in acido carbonico e nei suoi prodotti di dissociazione, attivando così un recettore che trasmette l’apposito impulso nervoso, che infine si trasforma nella sensazione irripetibile e caratteristica del solletico in bocca! Che complessa trafila!
Il pregiato e durevole effetto che solletica la lingua al primo sorso, è causato solo in parte dallo scoppio delle bolle di CO2 che si riversano sulla superficie ruvida della lingua. L’effetto è coadiuvato in maniera sostanziale dal biossido di carbonio disciolto, che riesce a penetrare agilmente negli strati più profondi della mucosa linguale. In questa sede, con l’aiuto di un enzima, la carbonato deidratasi, la CO2 viene convertita in acido carbonico e nei suoi prodotti di dissociazione, attivando così un recettore che trasmette l’apposito impulso nervoso, che infine si trasforma nella sensazione irripetibile e caratteristica del solletico in bocca! Che complessa trafila!
 La “nebbiolina” che appare sulla bottiglia di champagne appena stappata è semplice acqua condensatasi rapidamente dall’atmosfera. Non è una scia chimica, ma il risultato della variazione di pressione della CO2 compressa all’interno della bottiglia, che si espande improvvisamente, assorbendo tutto il calore circostante e riuscendo a condensare o addirittura congelare l’umidità ambientale nel campo d’azione del tappo.
La “nebbiolina” che appare sulla bottiglia di champagne appena stappata è semplice acqua condensatasi rapidamente dall’atmosfera. Non è una scia chimica, ma il risultato della variazione di pressione della CO2 compressa all’interno della bottiglia, che si espande improvvisamente, assorbendo tutto il calore circostante e riuscendo a condensare o addirittura congelare l’umidità ambientale nel campo d’azione del tappo.
Lo champagne deve rispettare almeno quindici mesi di invecchiamento nelle cantine dopo il periodo iniziale di fermentazione che dura tre settimane. Per lo champagne maturo il periodo dura tre anni. Come risultato di questo lungo periodo di invecchiamento, le cantine dei produttori di Champagne devono riuscire a immagazzinare oltre un miliardo e mezzo di bottiglie.
La fermentazione alcolica è il primo processo biotecnologico sfruttato dall’uomo, una forma di metabolismo energetico che non è solo alla base della produzione di vini e spumanti, ma anche della birra e dei prodotti da forno come il pane.
Nella massima semplificazione della preparazione di un vino spumante che si possa immaginare (occhio, è solo un esperimento ideale!), basterebbe procurarsi del succo d’uva e del lievito, riempire una bottiglia e sigillarla bene. Fortunatamente, qualche piccola conoscenza di stechiometria e alcuni calcoli ci mettono al riparo da incaute miscele e situazioni pericolose.
C6H12O6 → 2 C2H5OH + 2 CO2
I rapporti stechiometrici ci raccontano che 180 g di glucosio producono 92 grammi di etanolo e 88 di biossido di carbonio, senza scendere nei decimali. Un litro di succo d’uva contiene circa 200 g di zuccheri, dai quali si ottengono 102 g di alcol etilico (13% in volume circa) e 98 g di biossido di carbonio, che alla pressione di un atmosfera e 0°C corrispondono a 38 litri.
A 10°C e una atmosfera, 1,6 grammi di CO2 si sciolgono in 0,75 L di acqua; secondo la Legge di Henry, la solubilità di un gas è proporzionale alla pressione che esercita sulla soluzione, quindi dopo la completa dissoluzione di 74 g di biossido di carbonio in 0,75 L di spumante, si svilupperebbe una pressione di ben 46 atmosfere! In funzione della temperatura, in realtà le pressioni sono così ripartite, con tanto di costante di Henry, per i più esigenti.
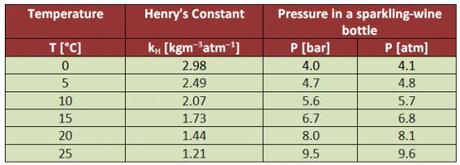
Pressione e solubilità per CO2 in a tipico spumante (12,5% etanolo, 10 g/L zucchero)
In altre parole, la fermentazione del succo d’uva direttamente in bottiglia provocherebbe inevitabilmente l’esplosione della stessa, non esistendo alcun vetro che possa resistere ad una tale pressione. In una bottiglia di vino spumante, la pressione del biossido di carbonio raggiunge normalmente pressioni comprese tra 4 a 6 atmosfere, e possono essere ottenute solo attraverso una fermentazione a due stadi: la prima senza costrizioni pneumatiche e la seconda in cui si sviluppa la pressione prescritta.
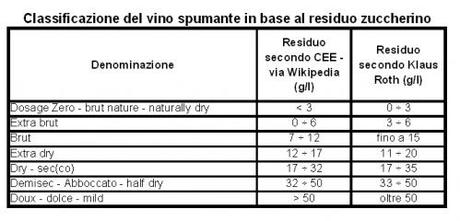
 Quando si trasferisce la miscela nei contenitori pressurizzati, inizia la seconda fermentazione. La concentrazione zuccherina infine si assesta caratterizzando la denominazione che lo spumante assumerà per l’etichetta. La classificazione comprende 7 categorie, delimitate dalla concentrazione in grammi per litro del residuo zuccherino. La tabella seguente compara i dati riportati dallo studio di Klaus Roth e la classificazione CEE riportata da Wikipedia. Diciamo che quest’ultima è leggermente meno … tollerante!
Quando si trasferisce la miscela nei contenitori pressurizzati, inizia la seconda fermentazione. La concentrazione zuccherina infine si assesta caratterizzando la denominazione che lo spumante assumerà per l’etichetta. La classificazione comprende 7 categorie, delimitate dalla concentrazione in grammi per litro del residuo zuccherino. La tabella seguente compara i dati riportati dallo studio di Klaus Roth e la classificazione CEE riportata da Wikipedia. Diciamo che quest’ultima è leggermente meno … tollerante!
 Forse non tutti sanno che lo Champagne genuino viene prodotto in una zona molto limitata, che comprende 36000 ettari complessivi fin dal 1927, e prende il nome dalla regione della Champagne, situata nel nord-est della Francia. I vini spumanti tuttavia sono superbi anche oltre i confini di quella regione, fra i più noti vi sono il Crémant francese, il Sekt in Germania, il Cava in Spagna, il Krimskoje (o Krimsekt) in Ucraina e ovviamente il sempre ottimo Spumante nostrano (lo so, sono spudoratamente di parte).
Forse non tutti sanno che lo Champagne genuino viene prodotto in una zona molto limitata, che comprende 36000 ettari complessivi fin dal 1927, e prende il nome dalla regione della Champagne, situata nel nord-est della Francia. I vini spumanti tuttavia sono superbi anche oltre i confini di quella regione, fra i più noti vi sono il Crémant francese, il Sekt in Germania, il Cava in Spagna, il Krimskoje (o Krimsekt) in Ucraina e ovviamente il sempre ottimo Spumante nostrano (lo so, sono spudoratamente di parte).
Ma cosa contiene esattamente una bottiglia da 75 centilitri di un tipico spumante? Lo sappiamo grazie ad uno studio citato (G. Liger-Belair et al., J. Agric. Food. Chem. 2009, 57, 4939. DOI: 10.1021/jf900804j), che stila con precisione tutti i componenti espressi in grammi contenuti nel “succo delle delle feste”:
- etanolo (75)
- CO2 (7,5 ÷ 9,0)
- glicerina (3,8)
- acido tartarico (1,9 ÷ 3,0)
- acido lattico (3,0)
- zuccheri (7,5 ÷ 38)
- proteine (0,004 ÷ 0,008)
- polisaccaridi (0,15)
- polifenoli (0,08)
- aminoacidi (0,0006 ÷ 0,0015 )
- composti organici volatili – VOC (0,53)
- lipidi (0,08)
- potassio (0,15 ÷ 0,30)
- calcio (0,05 ÷ 0,10)
- magnesio (0,04 ÷ 0,08)
- solfati (0,15)
- cloruri (0,008)
- pH = 3,5
- viscosità = 1,5 x 10-3 kg m-1 s-1
- tensione superficiale = 50 mN m-1

Lo spumante arriva alla testa molto velocemente, la conferma giunge da uno studio recente di Fran Ridout dell’Università di Surrey in Guildford, Regno Unito, e anche in questo caso gran parte della responsabilità del fenomeno è attribuibile alle bollicine di CO2.
Nello studio di Ridout, 12 volontari hanno bevuto due bicchieri di champagne. La quantità esatta è stata calibrata in modo che tutti i soggetti metabolizzassero la stessa quantità di alcool per kg di peso corporeo. A metà dei soggetti è stato somministrato champagne fresco, mentre all’altra metà è toccato uno champagne previamente sgasato con un cucchiaino.
Dopo cinque minuti, lo champagne frizzante aveva prodotto un contenuto di alcol nel sangue dello 0,54%, mentre quello sgasato solo lo 0,39%. Dopo 40 minuti i valori erano rispettivamente a 0,70% e 0,59%. A quanto pare, le bolle scoppiando stimolano le pareti dello stomaco, con conseguente aumento della circolazione, che a sua volta provoca l’assorbimento di alcol nel sangue in modo più rapido. Ecco spiegata la velocità delle sbronze da spumante, il propellente fatale in questo caso è proprio la CO2, chi l’avrebbe mai pensato?
Il famoso gourmet francese Jean Brillat-Savarin ha sapientemente sintetizzato le proprietà dello champagne in un suo simpatico aforisma:
“La Borgogna fa pensare a cose sciocche, il Bordeaux ti fa parlare di loro, e lo Champagne te le fa fare.”
Anche se forse è troppo tardi, dato che avevo programmato l’uscita di questo articolo ieri, ma che a causa di un imprevisto non ho rispettato, magari potrebbe ancora essere interessante apprendere, anche per la prossima volta, qual’è il miglior metodo per conservare una bottiglia con un residuo di spumante avanzato, troppo per essere buttato impietosamente nel lavandino, rendendoci complici di uno spreco imperdonabile!
 Qualcuno avrà sicuramente provato il celebre innesto del cucchiaino (preferibilmente di argento), spesso suggerito dall’esperto di turno. C’è del misticismo in questo, come può un cucchiaino appeso in una bottiglia riuscire a ritardare il rilascio di anidride carbonica, o si tratta di una leggenda urbana?
Qualcuno avrà sicuramente provato il celebre innesto del cucchiaino (preferibilmente di argento), spesso suggerito dall’esperto di turno. C’è del misticismo in questo, come può un cucchiaino appeso in una bottiglia riuscire a ritardare il rilascio di anidride carbonica, o si tratta di una leggenda urbana?
Finora ogni tentativo di confermare ciò che giurano schiere di sommellier si è rivelato un fallimento. Se ci avete già provato, allora saprete che una bottiglia di spumante aperta in frigo, dopo un giorno perde irrimediabilmente gran parte della sua freschezza, con o senza un cucchiaio d’argento. Richard Zare e un piccolo gruppo di suoi amici della Stanford University, si sono dedicati a questo problema con un progetto auto-finanziato. Così, cinque bottiglie distinte di un vino spumante californiano sono state degustate alla cieca dopo i seguenti trattamenti:
Bottiglia 1: poco prima della degustazione alla cieca è stata prelevata dal frigorifero e aperta, una parte è stata versata in un bicchiere.
Bottiglia 2: aperta 26 ore prima, dopo aver spillato un bicchiere, la bottiglia è stata riposta in frigorifero.
Bottiglia 3: di nuovo aperta 26 ore prima, con un aliquota versata in un bicchiere, quindi riposta in frigorifero, ma questa volta con un cucchiaio d’argento infilato nel collo della bottiglia.
Bottiglia 4: aperta 26 ore prima, una parte versata in un bicchiere, e la bottiglia riposta in frigorifero, ma con un cucchiaio di acciaio inossidabile infilato nel collo della bottiglia.
Bottiglia 5: aperta 26 ore prima, una parte versata in un bicchiere, ma questa volta la bottiglia è stata ritappata prima di essere rimessa in frigorifero.
Nonostante le ovvie incertezze statistiche e il gruppo eterogeneo di assaggiatori non proprio esperti, i risultati sembrano molto chiari:
Al primo posto la bottiglia 2, che è stata lasciata aperta una notte in frigorifero, conservando un’inaspettata freschezza del vino spumante al meglio della sua forma. Si è così scoperto che lo spumante ha un sapore migliore rispetto ad una bottiglia appena aperta (bottiglia 1), a cui spetta solo il secondo posto. Le bottiglie 3 e 4 ottengono a pari merito la posizione numero tre, sconfessando in questo frangente la nobiltà dell’argento nei confronti del ben più povero acciaio. La bottiglia ritappata rimane all’ultimo posto, il parere dei giudici ha decretato questa pratica come il modo più sicuro per garantire un gusto piatto e meno esaltante fra tutti i metodi di preservazione di una bottiglia iniziata.
Il risultato è molto chiaro: un vino spumante aperto deve essere cautamente riposto senza agitarlo troppo in frigorifero, con la bottiglia rigorosamente aperta. E’ importante non cercare di infilare un tappo di sughero mutilato da diversi affettamenti, che oltre ad essere una pratica pericolosa in certi stati mentali, può causare la contaminazione di numerosi piccoli frammenti di sughero che si tuffano nel liquido, facilitando in tal modo la formazione continua di bollicine che accelera lo sgasamento. L’unico modo efficace per preservare il gusto, indipendentemente dalla legge di Henry, dalla termodinamica in generale, dalla formazione di file di perle gassose, è semplicemente quello di berlo tutto e subito!
Quindi, kanpai, cin cin, cheers, prosit e cosi sia! Buon anno internazionale della chimica a tutti, e naturalmente non dimenticate di consultare il calendario delle iniziative e altre utilissime informazioni rese disponibili da Chimicare, e cercate di partecipare numerosi agli imminenti carnevali della chimica, prossimamente anche su questo blog.
Riferimenti:
Roth, K. (2010). Sparkling Wine, Champagne & Co – Part 1 ChemViews DOI: 10.1002/chemv.201000042
Roth, K. (2010). Sparkling Wine, Champagne & Co – Part 2 ChemViews DOI: 10.1002/chemv.201000043
Roth, K. (2010). Sparkling Wine, Champagne & Co – Part 3 ChemViews DOI: 10.1002/chemv.201000047
Immagini tratte da Wikipedia e da Chemistryviews






